吴凡科学家工作室:高安全、宽温区、微外压、无枝晶的硫化物基锂电池
来源:原创 | 2022年11月09日
 锂金属由于有最低的电化学电位(0V vs. Li/Li+)和超高的理论容量(3861 mAh/g)而被认为是“圣杯”负极(即锂金属负极)。然而,当与易燃液体电解液(LEs)结合时,存在循环效率差、SEI层重复形成、锂枝晶成核/生长和安全问题。用固体电解质(SEs)替代LEs理论上可以解决安全问题,但界面接触不良和严重的界面反应会大大降低使用无机SEs的全固态锂电池(ASSLBs)的性能。而且,在ASSLBs中,为了改善锂金属阳极与SEs的界面接触,往往需要超高的外部压力,不适合大规模生产和实际应用。
锂金属由于有最低的电化学电位(0V vs. Li/Li+)和超高的理论容量(3861 mAh/g)而被认为是“圣杯”负极(即锂金属负极)。然而,当与易燃液体电解液(LEs)结合时,存在循环效率差、SEI层重复形成、锂枝晶成核/生长和安全问题。用固体电解质(SEs)替代LEs理论上可以解决安全问题,但界面接触不良和严重的界面反应会大大降低使用无机SEs的全固态锂电池(ASSLBs)的性能。而且,在ASSLBs中,为了改善锂金属阳极与SEs的界面接触,往往需要超高的外部压力,不适合大规模生产和实际应用。
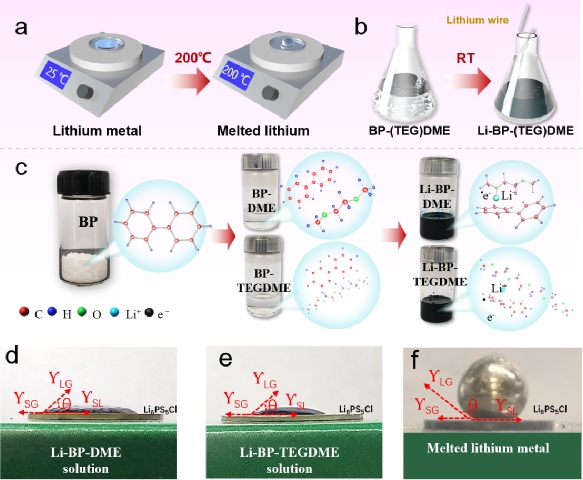
为了解决上述问题,实现安全性和界面接触更好的高能量密度电池,液态锂负极和固态电解质的组合已经引起了越来越多的关注。一种可能的方法是将熔融锂金属负极与石榴石型SEs结合,建立的液-固界面可以在高电流密度100mA cm-2下抑制锂枝晶生长。然而,熔融锂和石榴石型SEs都需要较高的运行温度(高于锂的熔点,200℃)以获得液体状态和较高的离子传导性,导致制造过程复杂,能耗高,有安全隐患,正极材料的选择有限,能源效率相对较低(75~89%)。另一种更好的方法是使用基于联苯(BP)的液态碱金属溶液作为负极材料,它在室温下表现出良好的安全性能和高电子/离子导电性。一些工作虽然报道了Li-BP-Ether液体负极与MOF或PVDF电解质在锂空气电池和液流电池中的应用。然而,迫切需要使用具有更高的离子电导率的SE,以改善扩散动力学,促进这种电池的能量效率。本工作开发了一种新的电池配置,采用室温液态锂金属作为负极,硫化物电解质Li6PS5Cl和LiCoO2固态正极材料。饱和Li-BP-Ether溶液作为金属锂和硫化物SE之间的保护性夹层,不仅保证了电极/电解质的充分接触,而且由于其高电子/离子混合导电性和溶解金属锂的能力,消除了锂枝晶。与熔融金属锂和氧化物SE相比,锂-联苯-醚溶液和硫化物SE都能在室温下良好运行,从而消除了200℃以上存在的所有挑战。此外,新的电池系统可以在可忽略的外部压力(3kPa)下运行,远远低于传统ASSLBs所需的高压。由于硫化物SE和Li-BP-DME溶液的高导电性(12 mS cm-1),新的电池配置在充放电过程中还表现出小的过电位和快速的反应动力学。因此,在30°C下可以实现高可逆放电容量(140.4 mAh g-1)和高效率(99.7 %的库仑效率和约100次循环后>96 %的能量效率)。该电池体系的循环稳定性、库仑效率和能源效率为迄今为止所有使用固态正极材料的液态锂溶液电池系统中报告的最佳性能水平。此外,它还在宽温度范围内(-20~50℃)表现出良好的性能。总的来说,本工作中的电池配置为高能量密度、高成本效益、高安全性、宽温度范围、低压力和无枝晶的可充电锂电池开辟了一条有前途的道路。该成果以“High-Safety, Wide-Temperature-Range, Low-External-Pressure and Dendrite-Free Lithium Battery with Sulfide Solid Electrolyte”为题发表在国际知名期刊Energy Storage Materials(IF=20.831)https://doi.org/10.1016/j.ensm.2022.10.057上,第一作者为中国科学院物理研究所博士生彭健,伍登旭。此研究项目获得长三角物理研究中心科学家工作室项目支持。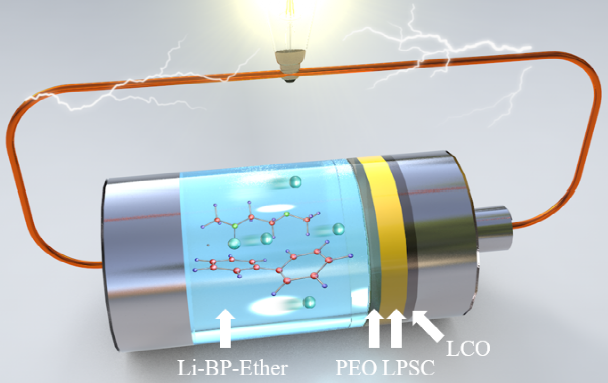 传统的锂金属负极需要加热到200℃以上才能融化(如图1a所示),这样一来,任何带有液态碱金属负极的电池都需要在高温下工作,这消耗了大量的能量,而且极其危险。相比之下,液态锂溶液(Li-BP-DME/TEGDME)的制备简单、高效,可以在室温下几个步骤内完成。金属锂会迅速溶解到联苯(BP)-醚溶剂中,形成液态锂溶液,如图1b所示。图1c展示了液态锂溶液中金属锂与芳香族化合物BP、醚类化合物C4H10O2(DME)和C10H22O5(TEGDME)之间的分子相互作用。溶液中的反应机制如下,Li和BP之间首先发生电荷转移反应,形成[(BP∙-)Li+]加合物,该加合物将通过锂离子与DME/TEGDME的配位进一步稳定,最后形成加合物[(BP∙-)Li+](C4H10O2)或[(BP∙-)Li+](C10H22O5)。此外,还研究了Li6PS5Cl(LPSC)固体电解质颗粒(带PEO-LiTFSI涂层,LPSC@PEO)上的液态锂负极的润湿性,并与融化的金属锂负极进行了比较(图1d-1f)。其中ƳLG、ƳSG、ƳSL和θ分别为液-气界面、固-气界面、固-液界面和接触角。结果显示,Li-BP-(TEG)DME液体在室温下铺满了LPSC@PEO的整个表面,表面完全湿润,接触角很小θ<90°(图1d和图1e)。这种润湿性比任何即使在200℃以上的高温下(θ>90°,图1f)的熔融碱金属或其合金的润湿性要好得多。图1 | Li-BP-(TEG)DME液体溶液的物理和化学特性。(a) 获得液态锂的制备过程示意图,其中金属锂需要在200℃以上加热。(b) 获得Li-BP(TEG)DME的制备过程示意图,该过程简单、高效,在室温(25℃)下操作。(c) Li-BP-(TEG)DME溶液的制备照片以及溶液中分子和原子之间相互作用的示意图。(d-f)Li-BP-DME、Li-PTEGDME和融化的金属锂在带有PEO-LiTFSI界面保护层(LPSC@PEO)的Li6PS5Cl固体电解质颗粒上的界面浸润性。锂金属电池的安全问题是最受关注的问题之一。由于锂金属的高反应性,其安全性是传统锂金属电池面临的主要挑战之一。金属锂与水接触产生氢气,在大气环境中剧烈燃烧(图2a),存在严重的安全隐患。此外,在连续沉积/剥离过程中,锂枝晶容易从金属锂负极处不断成核生长,导致液态电解液锂金属电池内部短路,最终导致热失控/火灾。以上两点带来了很大的安全隐患,阻碍了锂金属电池的应用。我们通过向Li-BP-(TEG)DME溶液中逐滴加水的方法,验证了Li-BP-(TEG)DME的安全性能,结果显示这种反应比锂金属要温和得多。虽然溶液的颜色由深蓝色/黑色变为透明色,但在整个过程中没有观察到明显的爆炸或明火 (图2b和图2c)。图2c中的Li-BP-TEGDME溶液与水的反应时间比Li-BP-DME更长,这是由于其锂浓度较高。此外,在反应过程中,溶液温度的升高的程度几乎可以忽略不计,放热比金属锂少得多。与金属锂相比,液态金属锂溶液(Li-BP-(TEG)DME)由于其不易燃的特性和抑制锂枝晶成核/生长的能力,其安全性得到了提高。这些优越的性能使得室温Li-BP-(TEG)DME电池本质上比高温熔融锂电池和锂金属液态电解液电池更安全。这也代表了将Li-BP-(TEG)DME电池系统用于大规模应用的一个极有前途的优势。图2 | Li-BP-DME、Li-BP-TEGDME和金属锂的安全测试。(a) 金属锂负极与蒸馏水的反应。(b) Li-BP-DME液体负极与蒸馏水的反应。(c) Li-BP-TEGDME液体负极与蒸馏水的反应。为了确定Li-BP-(TEG)DME液体溶液的氧化还原电位,制作了Li-BP-DME//LPSC@PEO//Li和Li-BP-TEGDME//LPSC@PEO //Li电池。这些电池的开路电压曲线见图3a,一系列的氧化还原电位从0.23 V到0.389 V与Li/Li+的关系见图3b。相对较低的氧化还原电位表明其作为负极材料具有良好的潜力。上述研究的液体锂溶液包括室温下的饱和溶液(Li2.67BP3DME10和Li2.67BP3TEGDME10)和不饱和溶液(Li0.5BP3DME10、Li1.0BP3DME10、Li1.5BP3DME10和Li2.0BP3DME10)。不饱和溶液可单独作为负极使用,饱和溶液可作为负极或作为金属锂负极的保护层。随着锂浓度的增加,以DME为溶剂的液态金属锂溶液的氧化还原电位从0.339V逐渐下降到0.23V,Li2.67BP3TEGDME10的氧化还原电位为0.389V。低电位有利于提高电池能量密度。电子和离子电导率是Li-BP-(TEG)DME溶液作为负极材料的关键参数。为了进一步研究饱和液态锂溶液(Li2.67BP3DME10和Li2.67BP3TEGDME10)的电化学性能,我们测量了它们在室温下的离子和电子电导率。图3c显示,Li2.67BP3DME10的阻值小于Li2.67BP3TEGDME10。经计算,Li2.67BP3DME10和Li2.67BP3TEGDME10的总电导率分别为12 mS cm-1和2.39 mS cm-1。这两种溶液的电子电导率是用等温瞬时离子电流(ITIC)方法测量的,Hebb-Wagner直流(DC)极化曲线(即电流-时间)显示在图3d。对于Li2.67BP3DME10,电流迅速下降并稳定在一个恒定值(0.9 mA),而对于Li2.67BP3TEGDME10,电流几乎保持在一个较低的值0.19 mA。Li2.67BP3DME10的离子和电子电导率(2.99 mS cm-1, 9.01 mS cm-1)比Li2.67BP3TEGDME10(0.49 mS cm-1, 1.90 mS cm-1)高。这些数值在图3e中进行了总结,Li2.67BP3DME10和Li2.67BP3TEGDME10相对较高的电导率数值使它们有资格成为有前途的负极材料。
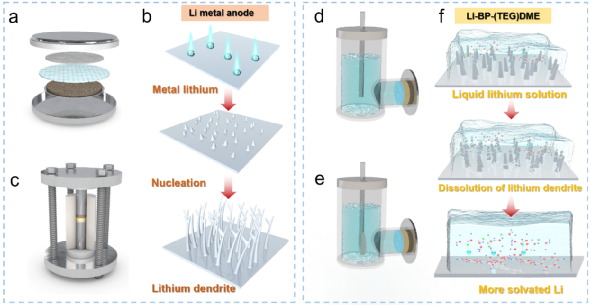
传统的锂金属负极需要加热到200℃以上才能融化(如图1a所示),这样一来,任何带有液态碱金属负极的电池都需要在高温下工作,这消耗了大量的能量,而且极其危险。相比之下,液态锂溶液(Li-BP-DME/TEGDME)的制备简单、高效,可以在室温下几个步骤内完成。金属锂会迅速溶解到联苯(BP)-醚溶剂中,形成液态锂溶液,如图1b所示。图1c展示了液态锂溶液中金属锂与芳香族化合物BP、醚类化合物C4H10O2(DME)和C10H22O5(TEGDME)之间的分子相互作用。溶液中的反应机制如下,Li和BP之间首先发生电荷转移反应,形成[(BP∙-)Li+]加合物,该加合物将通过锂离子与DME/TEGDME的配位进一步稳定,最后形成加合物[(BP∙-)Li+](C4H10O2)或[(BP∙-)Li+](C10H22O5)。此外,还研究了Li6PS5Cl(LPSC)固体电解质颗粒(带PEO-LiTFSI涂层,LPSC@PEO)上的液态锂负极的润湿性,并与融化的金属锂负极进行了比较(图1d-1f)。其中ƳLG、ƳSG、ƳSL和θ分别为液-气界面、固-气界面、固-液界面和接触角。结果显示,Li-BP-(TEG)DME液体在室温下铺满了LPSC@PEO的整个表面,表面完全湿润,接触角很小θ<90°(图1d和图1e)。这种润湿性比任何即使在200℃以上的高温下(θ>90°,图1f)的熔融碱金属或其合金的润湿性要好得多。图1 | Li-BP-(TEG)DME液体溶液的物理和化学特性。(a) 获得液态锂的制备过程示意图,其中金属锂需要在200℃以上加热。(b) 获得Li-BP(TEG)DME的制备过程示意图,该过程简单、高效,在室温(25℃)下操作。(c) Li-BP-(TEG)DME溶液的制备照片以及溶液中分子和原子之间相互作用的示意图。(d-f)Li-BP-DME、Li-PTEGDME和融化的金属锂在带有PEO-LiTFSI界面保护层(LPSC@PEO)的Li6PS5Cl固体电解质颗粒上的界面浸润性。锂金属电池的安全问题是最受关注的问题之一。由于锂金属的高反应性,其安全性是传统锂金属电池面临的主要挑战之一。金属锂与水接触产生氢气,在大气环境中剧烈燃烧(图2a),存在严重的安全隐患。此外,在连续沉积/剥离过程中,锂枝晶容易从金属锂负极处不断成核生长,导致液态电解液锂金属电池内部短路,最终导致热失控/火灾。以上两点带来了很大的安全隐患,阻碍了锂金属电池的应用。我们通过向Li-BP-(TEG)DME溶液中逐滴加水的方法,验证了Li-BP-(TEG)DME的安全性能,结果显示这种反应比锂金属要温和得多。虽然溶液的颜色由深蓝色/黑色变为透明色,但在整个过程中没有观察到明显的爆炸或明火 (图2b和图2c)。图2c中的Li-BP-TEGDME溶液与水的反应时间比Li-BP-DME更长,这是由于其锂浓度较高。此外,在反应过程中,溶液温度的升高的程度几乎可以忽略不计,放热比金属锂少得多。与金属锂相比,液态金属锂溶液(Li-BP-(TEG)DME)由于其不易燃的特性和抑制锂枝晶成核/生长的能力,其安全性得到了提高。这些优越的性能使得室温Li-BP-(TEG)DME电池本质上比高温熔融锂电池和锂金属液态电解液电池更安全。这也代表了将Li-BP-(TEG)DME电池系统用于大规模应用的一个极有前途的优势。图2 | Li-BP-DME、Li-BP-TEGDME和金属锂的安全测试。(a) 金属锂负极与蒸馏水的反应。(b) Li-BP-DME液体负极与蒸馏水的反应。(c) Li-BP-TEGDME液体负极与蒸馏水的反应。为了确定Li-BP-(TEG)DME液体溶液的氧化还原电位,制作了Li-BP-DME//LPSC@PEO//Li和Li-BP-TEGDME//LPSC@PEO //Li电池。这些电池的开路电压曲线见图3a,一系列的氧化还原电位从0.23 V到0.389 V与Li/Li+的关系见图3b。相对较低的氧化还原电位表明其作为负极材料具有良好的潜力。上述研究的液体锂溶液包括室温下的饱和溶液(Li2.67BP3DME10和Li2.67BP3TEGDME10)和不饱和溶液(Li0.5BP3DME10、Li1.0BP3DME10、Li1.5BP3DME10和Li2.0BP3DME10)。不饱和溶液可单独作为负极使用,饱和溶液可作为负极或作为金属锂负极的保护层。随着锂浓度的增加,以DME为溶剂的液态金属锂溶液的氧化还原电位从0.339V逐渐下降到0.23V,Li2.67BP3TEGDME10的氧化还原电位为0.389V。低电位有利于提高电池能量密度。电子和离子电导率是Li-BP-(TEG)DME溶液作为负极材料的关键参数。为了进一步研究饱和液态锂溶液(Li2.67BP3DME10和Li2.67BP3TEGDME10)的电化学性能,我们测量了它们在室温下的离子和电子电导率。图3c显示,Li2.67BP3DME10的阻值小于Li2.67BP3TEGDME10。经计算,Li2.67BP3DME10和Li2.67BP3TEGDME10的总电导率分别为12 mS cm-1和2.39 mS cm-1。这两种溶液的电子电导率是用等温瞬时离子电流(ITIC)方法测量的,Hebb-Wagner直流(DC)极化曲线(即电流-时间)显示在图3d。对于Li2.67BP3DME10,电流迅速下降并稳定在一个恒定值(0.9 mA),而对于Li2.67BP3TEGDME10,电流几乎保持在一个较低的值0.19 mA。Li2.67BP3DME10的离子和电子电导率(2.99 mS cm-1, 9.01 mS cm-1)比Li2.67BP3TEGDME10(0.49 mS cm-1, 1.90 mS cm-1)高。这些数值在图3e中进行了总结,Li2.67BP3DME10和Li2.67BP3TEGDME10相对较高的电导率数值使它们有资格成为有前途的负极材料。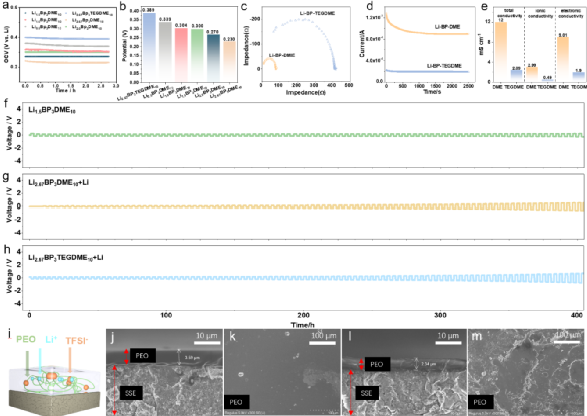 图 3 | (a)Li-BP-(TEG)DME/LPSC/Li电池在室温下的开路电压。(b) 不同成分的Li-BP-(TEG)DME液体溶液的氧化还原电位汇总。(c) 室温下Li2.67BP3DME10和Li2.67BP3TEGDME10的电化学阻抗谱。(d) 室温下Li2.67BP3DME10和Li2.67BP3TEGDME10的直流极化曲线。(e) Li2.67BP3DME10和Li2.67BP3TEGDME10在室温下的总电导率、离子电导率和电子电导率的总结。(f-h)Li1.5BP3DME10/LPSC@PEO/Li1.5BP3DME10 电池、(Li2.67BP3DME10+Li)/ LPSC@PEO/(Li2.67BP3DME10+Li)电池和(Li2.67BP3TEGDME10+Li)/ LPSC@PEO/(Li2.67BP3TEGDME10+Li)电池在30℃下电流密度为0.127 mA cm-2的静电放电/充电电压曲线。(i) 带有PEO保护层的硫化物SE颗粒的示意图。(j-m) 循环前和循环后PEO保护层的横截面和平面SEM图片。(j) SEM图像显示循环前PEO界面层的横截面形态。(k) SEM图像显示循环前PEO界面层的平面形态。(l) SEM图像显示循环后PEO界面层的横截面形态。(m) SEM图像显示循环后PEO界面层的平面形态。在对称电池(Li1.5BP3DME10/ LPSC@PEO/ Li1.5BP3DME10)中证明了这些液体溶液的电化学可逆的锂沉积/剥离,其中不饱和液体锂阳极Li1.5BP3DME10显示出良好的循环稳定性,400小时的过电位低至0.22 V(图3f)。此外,为了测试金属锂负极和饱和液体金属锂溶液作为金属锂保护层的电池的循环稳定性,组装了对称电池(Li2.67BP3DME10+Li)/LPSC@PEO/(Li2.67BP3DME10+Li)和(Li2.67BP3TEGDME10+Li)/LPSC@PEO/(Li2.67BP3TEGDME10+Li)。这些电池的电压曲线显示在图3g和图3h。两种对称电池都表现出低的初始过电位(Li2.67BP3DME10+Li为0.075V,Li2.67BP3TEGDME10+Li为0.257V)和400小时的稳定循环(图3g和图3h)。低初始过电位和长周期稳定性归因于良好的界面接触和液体锂溶液的高导电性。此外,由于PEO具有良好的机械性能,它可以在物理上防止液态锂溶液和硫化物SE之间的接触。此外,由于PEO的醚键与Li-BP-(TEG)DME溶液中的(TEG)DME成分有很好的亲和力,因此PEO在室温下的离子导电性能得到改善,以减少界面阻抗。换句话说,(TEG)DME可以作为增塑剂发挥作用。上述结果表明,含有LPSC@PEO的Li1.5BP3DME10和Li2.67BP3(TEG)DME10+Li的电池体系可以在锂金属电池中很好地发挥实际应用。对PEO保护的硫化物SE在使用Li1.5BP3DME10负极的对称电池循环之前和之后的横截面和平面形态进行了SEM表征。循环前的原始SE的图像在左边(图3j, 3k),循环后的图像在右边(图3l, 3m)。图3j显示,循环前PEO层的厚度约为3.59μm,而循环后减少到2.34μm(图3l)。尽管有轻微的厚度损失,但PEO涂层下的硫化物SE没有孔隙或裂缝,证明PEO界面层可以有效地阻止液体锂溶液与硫化物SE发生反应。厚度的轻微损失可能是由于PEO层中少量残留的乙腈溶剂和锂盐(LiTFSI)溶解到液态锂溶液中造成的(图S2)。此外,图3k显示了循环前致密和均匀的表面形态,图3m显示了PEO相对均匀的表面,即使在100小时的循环后也没有明显的孔隙/裂缝。这些SEM结果表明,PEO与液态锂溶液有良好的化学稳定性,这与对称电池的良好循环稳定性很好地对应。图4为更好地解释液态锂溶液对锂枝晶的抑制能力的示意图。在使用液体电解质的锂金属电池中(图4a),充/放电过程中无序的锂枝晶沉积(图4b)不仅会导致 "死锂 "和快速的容量衰减,还会诱发内部短路和热失控。尽管使用不易燃的SE的全固态锂金属电池(图4c)预计比基于液体电解质的LIB更安全,但据报道,锂枝晶在SE中比在液体电解质中更容易生长,因为当电流密度和面积容量增加到一定值时,金属锂倾向于在SE的孔隙和晶界处成核和生长,并最终渗透穿透电解质层,导致电池失效。不均匀的锂沉积主要发生在由于SE-锂金属接触不良或电解质压实密度低而产生的缺陷上,这些缺陷为锂枝晶的生长提供了活性位点。晶粒、晶界或界面之间的导电性差异也会导致枝晶的优先沉积。有人提出了电镀诱导的锂渗透模型,表明锂沉积在缺陷部位并导致裂纹尖端的应力,以促进裂纹的生长。与这些常见的电池系统不同,液态锂溶液的引入创造了一种新的电池配置。图4d和图4e分别是采用不饱和液态锂溶液Li1.5BP3DME10负极和饱和液态锂溶液与固体锂片负极(Li2.67BP3(TEG)DME10+Li)的电池示意图。当使用不饱和液体锂溶液负极时,锂离子可以与联苯基阴离子相互作用,在镀锂过程中形成稳定的加合物。这意味着锂枝晶的成核和生长不会在不饱和液态锂溶液中发生。当应用饱和的Li2.67BP3(TEG)DME10+Li负极时,由于溶液的高离子/电子传导性,锂枝晶也很难形成。即使在极端的假设/条件下,镀锂过程中产生了锂枝晶,饱和溶液内的锂枝晶也会在接下来的剥离过程中优先被消耗掉,因为它们的表面存在较低的阻抗途径(图4f)。更重要的是,由于液态锂溶液的高电子传导性,"死锂 "问题可以被避免。图4 | 不同电池配置和锂枝晶的生长/溶解过程示意图。(a) 带有液体电解质的锂金属电池的示意图。(b) 锂金属电池中锂枝晶的成核和生长过程示意图。(c) 全固态硫化物锂金属电池的示意图。(d) Li1.5BP3DME10负极的电池示意图。(e) 以Li2.67BP3(TEG)DME10+Li为负极的电池示意图。(f) 液体锂溶液(Li-BP-(TEG)DME)中的锂枝晶溶解示意图。基于液态锂溶液的这些独特特性和该电池系统良好的循环稳定性,我们进一步组装和研究了使用这种液体作为负极或金属锂负极保护层的可充电电池。图5a显示了特别设计的使用液态锂溶液作为负极的电池的真实照片,图5b-c显示了详细的组件。从左到右分别是Li-BP-DME、硅胶片、LCO+SE@PEO片、铝(Al)箔、钢片和硅胶片。由于硅胶片对液态金属锂溶液和PEO的柔韧性和化学稳定性,它可以有效地保证电池的密封性,防止液态金属锂溶液/电解质片暴露在空气中。铝箔是正极的集流体,钢板起着支撑作用,确保LCO正极和铝箔集流体之间的紧密接触。图5c是三层物质(LCO+SE@PEO)的示意图和放大图。这里使用固体正极LiCoO2来证明室温液体金属硫化物SE电池的实际应用可行性。LCO正极材料上有Li2ZrO3(LZO)作为保护层,隔离了硫化物SE和LCO的直接接触,大大限制了界面副反应。研究了室温下使用不饱和液态金属锂溶液Li1.5BP3DME10(LZO@LCO/LPSC@PEO/ Li1.5BP3DME10)和饱和液态金属锂与固体锂片(LZO@LCO/LPSC@PEO/Li2.67BP3(TEG)DME10/Li)的全电池电化学性能。图5d、5g和5j显示了这些电池在2.5-4.0 V的电压范围内的充/放电曲线。Li1.5BP3DME10具有在室温下各种LixBPy(TEG)DMEz中最高的离子电导率,使用Li1.5BP3DME10的电池在第1、2、10、60和70个周期的充/放电曲线如图5d所示。第一周期的比容量为128.4 mAh/g,接近于金属锂负极和硫化物SE的电池(图S5)。充电和放电电压平台为~3.6V,显示了高输出电压和能量密度。图5e显示了该电池的循环性能,71次循环后容量保持率为89.56%。首周库仑效率相对较低,为84.94%,但从第二周期开始迅速增加到99%以上,并保持这一数值直到第71周。此外,首周能量效率为83.41%,直到第71个周,能量效率稳定(超过96%)。图5f显示了不同倍率下的可逆放电容量(在0.1C、0.2C、0.5C、1C和2C下分别为140、132 117、97和64 mAh g-1),在高倍率测试后,在0.1C下可以恢复140 mAh g-1的高容量。这些结果证实了不饱和液态金属锂溶液可以单独作为负极使用。为了验证饱和液态金属锂作为保护层在室温下的全电池性能,研究了饱和液态锂溶液和固态金属锂片(Li2.67BP3(TEG)DME10+Li)在室温下的全电池。图5g显示了(Li2.67BP3DME10+Li)电池在第1、2、10、50、88和96个周期的充放电曲线。第一周期的比容量为135.4 mAh g-1,这接近于LCO的理论比容量(140 mAh g-1)。然而,由于充/放电电压高点是~3.6V,小于LCO对Li/Li+的电压(3.9V),真正起作用的负极实际上是Li2.67BP3DME10而不是金属锂。应该注意的是,棒状的集流体在负极一侧与液态锂溶液和金属锂接触,LCO正极(1毫克)中的锂容量约为0.27 mAh,比Li2.67BP3(TEG)DME10(5毫升,约250 mAh)小得多。因此,液态锂溶液在整个循环过程中可以经历完整的氧化还原反应,其化学状态的变化可以忽略不计。在这种情况下,金属锂不能作为锂源发挥作用。然而,金属钠作为Na-BP-DEGDME中的Na源的有效性已经被Kim等人报告/证实了。因此,可以合理地预测,在较大的正极负载和较小的液态锂剂量下,由于金属锂负极的参与,能量密度可以得到大幅度的提高。图5h显示,88次循环后的容量保持率为89.21%,96次循环后为80%。容量衰减可能是由漏气导致的液态锂溶液的恶化造成的。首周库仑效率相对较低,为81.05%,但从第3个循环开始增加到99%以上,并一直保持到第96个循环。图5i显示了不同倍率下的可逆放电容量(在0.1C、0.2 C、0.5 C、1 C和2 C时分别为133、122、106、88和56 mAh g-1),并且当回到0.1C时将138 mAh g-1的高容量恢复。
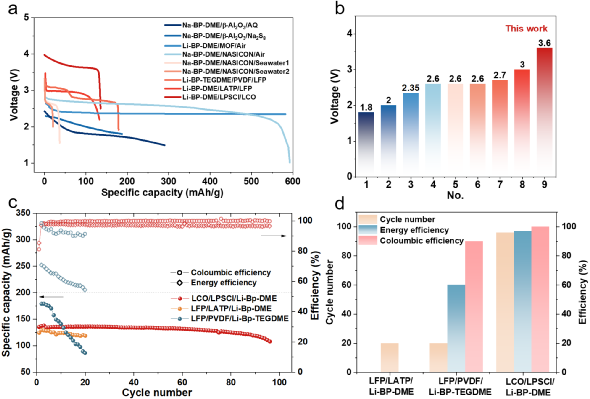
图 3 | (a)Li-BP-(TEG)DME/LPSC/Li电池在室温下的开路电压。(b) 不同成分的Li-BP-(TEG)DME液体溶液的氧化还原电位汇总。(c) 室温下Li2.67BP3DME10和Li2.67BP3TEGDME10的电化学阻抗谱。(d) 室温下Li2.67BP3DME10和Li2.67BP3TEGDME10的直流极化曲线。(e) Li2.67BP3DME10和Li2.67BP3TEGDME10在室温下的总电导率、离子电导率和电子电导率的总结。(f-h)Li1.5BP3DME10/LPSC@PEO/Li1.5BP3DME10 电池、(Li2.67BP3DME10+Li)/ LPSC@PEO/(Li2.67BP3DME10+Li)电池和(Li2.67BP3TEGDME10+Li)/ LPSC@PEO/(Li2.67BP3TEGDME10+Li)电池在30℃下电流密度为0.127 mA cm-2的静电放电/充电电压曲线。(i) 带有PEO保护层的硫化物SE颗粒的示意图。(j-m) 循环前和循环后PEO保护层的横截面和平面SEM图片。(j) SEM图像显示循环前PEO界面层的横截面形态。(k) SEM图像显示循环前PEO界面层的平面形态。(l) SEM图像显示循环后PEO界面层的横截面形态。(m) SEM图像显示循环后PEO界面层的平面形态。在对称电池(Li1.5BP3DME10/ LPSC@PEO/ Li1.5BP3DME10)中证明了这些液体溶液的电化学可逆的锂沉积/剥离,其中不饱和液体锂阳极Li1.5BP3DME10显示出良好的循环稳定性,400小时的过电位低至0.22 V(图3f)。此外,为了测试金属锂负极和饱和液体金属锂溶液作为金属锂保护层的电池的循环稳定性,组装了对称电池(Li2.67BP3DME10+Li)/LPSC@PEO/(Li2.67BP3DME10+Li)和(Li2.67BP3TEGDME10+Li)/LPSC@PEO/(Li2.67BP3TEGDME10+Li)。这些电池的电压曲线显示在图3g和图3h。两种对称电池都表现出低的初始过电位(Li2.67BP3DME10+Li为0.075V,Li2.67BP3TEGDME10+Li为0.257V)和400小时的稳定循环(图3g和图3h)。低初始过电位和长周期稳定性归因于良好的界面接触和液体锂溶液的高导电性。此外,由于PEO具有良好的机械性能,它可以在物理上防止液态锂溶液和硫化物SE之间的接触。此外,由于PEO的醚键与Li-BP-(TEG)DME溶液中的(TEG)DME成分有很好的亲和力,因此PEO在室温下的离子导电性能得到改善,以减少界面阻抗。换句话说,(TEG)DME可以作为增塑剂发挥作用。上述结果表明,含有LPSC@PEO的Li1.5BP3DME10和Li2.67BP3(TEG)DME10+Li的电池体系可以在锂金属电池中很好地发挥实际应用。对PEO保护的硫化物SE在使用Li1.5BP3DME10负极的对称电池循环之前和之后的横截面和平面形态进行了SEM表征。循环前的原始SE的图像在左边(图3j, 3k),循环后的图像在右边(图3l, 3m)。图3j显示,循环前PEO层的厚度约为3.59μm,而循环后减少到2.34μm(图3l)。尽管有轻微的厚度损失,但PEO涂层下的硫化物SE没有孔隙或裂缝,证明PEO界面层可以有效地阻止液体锂溶液与硫化物SE发生反应。厚度的轻微损失可能是由于PEO层中少量残留的乙腈溶剂和锂盐(LiTFSI)溶解到液态锂溶液中造成的(图S2)。此外,图3k显示了循环前致密和均匀的表面形态,图3m显示了PEO相对均匀的表面,即使在100小时的循环后也没有明显的孔隙/裂缝。这些SEM结果表明,PEO与液态锂溶液有良好的化学稳定性,这与对称电池的良好循环稳定性很好地对应。图4为更好地解释液态锂溶液对锂枝晶的抑制能力的示意图。在使用液体电解质的锂金属电池中(图4a),充/放电过程中无序的锂枝晶沉积(图4b)不仅会导致 "死锂 "和快速的容量衰减,还会诱发内部短路和热失控。尽管使用不易燃的SE的全固态锂金属电池(图4c)预计比基于液体电解质的LIB更安全,但据报道,锂枝晶在SE中比在液体电解质中更容易生长,因为当电流密度和面积容量增加到一定值时,金属锂倾向于在SE的孔隙和晶界处成核和生长,并最终渗透穿透电解质层,导致电池失效。不均匀的锂沉积主要发生在由于SE-锂金属接触不良或电解质压实密度低而产生的缺陷上,这些缺陷为锂枝晶的生长提供了活性位点。晶粒、晶界或界面之间的导电性差异也会导致枝晶的优先沉积。有人提出了电镀诱导的锂渗透模型,表明锂沉积在缺陷部位并导致裂纹尖端的应力,以促进裂纹的生长。与这些常见的电池系统不同,液态锂溶液的引入创造了一种新的电池配置。图4d和图4e分别是采用不饱和液态锂溶液Li1.5BP3DME10负极和饱和液态锂溶液与固体锂片负极(Li2.67BP3(TEG)DME10+Li)的电池示意图。当使用不饱和液体锂溶液负极时,锂离子可以与联苯基阴离子相互作用,在镀锂过程中形成稳定的加合物。这意味着锂枝晶的成核和生长不会在不饱和液态锂溶液中发生。当应用饱和的Li2.67BP3(TEG)DME10+Li负极时,由于溶液的高离子/电子传导性,锂枝晶也很难形成。即使在极端的假设/条件下,镀锂过程中产生了锂枝晶,饱和溶液内的锂枝晶也会在接下来的剥离过程中优先被消耗掉,因为它们的表面存在较低的阻抗途径(图4f)。更重要的是,由于液态锂溶液的高电子传导性,"死锂 "问题可以被避免。图4 | 不同电池配置和锂枝晶的生长/溶解过程示意图。(a) 带有液体电解质的锂金属电池的示意图。(b) 锂金属电池中锂枝晶的成核和生长过程示意图。(c) 全固态硫化物锂金属电池的示意图。(d) Li1.5BP3DME10负极的电池示意图。(e) 以Li2.67BP3(TEG)DME10+Li为负极的电池示意图。(f) 液体锂溶液(Li-BP-(TEG)DME)中的锂枝晶溶解示意图。基于液态锂溶液的这些独特特性和该电池系统良好的循环稳定性,我们进一步组装和研究了使用这种液体作为负极或金属锂负极保护层的可充电电池。图5a显示了特别设计的使用液态锂溶液作为负极的电池的真实照片,图5b-c显示了详细的组件。从左到右分别是Li-BP-DME、硅胶片、LCO+SE@PEO片、铝(Al)箔、钢片和硅胶片。由于硅胶片对液态金属锂溶液和PEO的柔韧性和化学稳定性,它可以有效地保证电池的密封性,防止液态金属锂溶液/电解质片暴露在空气中。铝箔是正极的集流体,钢板起着支撑作用,确保LCO正极和铝箔集流体之间的紧密接触。图5c是三层物质(LCO+SE@PEO)的示意图和放大图。这里使用固体正极LiCoO2来证明室温液体金属硫化物SE电池的实际应用可行性。LCO正极材料上有Li2ZrO3(LZO)作为保护层,隔离了硫化物SE和LCO的直接接触,大大限制了界面副反应。研究了室温下使用不饱和液态金属锂溶液Li1.5BP3DME10(LZO@LCO/LPSC@PEO/ Li1.5BP3DME10)和饱和液态金属锂与固体锂片(LZO@LCO/LPSC@PEO/Li2.67BP3(TEG)DME10/Li)的全电池电化学性能。图5d、5g和5j显示了这些电池在2.5-4.0 V的电压范围内的充/放电曲线。Li1.5BP3DME10具有在室温下各种LixBPy(TEG)DMEz中最高的离子电导率,使用Li1.5BP3DME10的电池在第1、2、10、60和70个周期的充/放电曲线如图5d所示。第一周期的比容量为128.4 mAh/g,接近于金属锂负极和硫化物SE的电池(图S5)。充电和放电电压平台为~3.6V,显示了高输出电压和能量密度。图5e显示了该电池的循环性能,71次循环后容量保持率为89.56%。首周库仑效率相对较低,为84.94%,但从第二周期开始迅速增加到99%以上,并保持这一数值直到第71周。此外,首周能量效率为83.41%,直到第71个周,能量效率稳定(超过96%)。图5f显示了不同倍率下的可逆放电容量(在0.1C、0.2C、0.5C、1C和2C下分别为140、132 117、97和64 mAh g-1),在高倍率测试后,在0.1C下可以恢复140 mAh g-1的高容量。这些结果证实了不饱和液态金属锂溶液可以单独作为负极使用。为了验证饱和液态金属锂作为保护层在室温下的全电池性能,研究了饱和液态锂溶液和固态金属锂片(Li2.67BP3(TEG)DME10+Li)在室温下的全电池。图5g显示了(Li2.67BP3DME10+Li)电池在第1、2、10、50、88和96个周期的充放电曲线。第一周期的比容量为135.4 mAh g-1,这接近于LCO的理论比容量(140 mAh g-1)。然而,由于充/放电电压高点是~3.6V,小于LCO对Li/Li+的电压(3.9V),真正起作用的负极实际上是Li2.67BP3DME10而不是金属锂。应该注意的是,棒状的集流体在负极一侧与液态锂溶液和金属锂接触,LCO正极(1毫克)中的锂容量约为0.27 mAh,比Li2.67BP3(TEG)DME10(5毫升,约250 mAh)小得多。因此,液态锂溶液在整个循环过程中可以经历完整的氧化还原反应,其化学状态的变化可以忽略不计。在这种情况下,金属锂不能作为锂源发挥作用。然而,金属钠作为Na-BP-DEGDME中的Na源的有效性已经被Kim等人报告/证实了。因此,可以合理地预测,在较大的正极负载和较小的液态锂剂量下,由于金属锂负极的参与,能量密度可以得到大幅度的提高。图5h显示,88次循环后的容量保持率为89.21%,96次循环后为80%。容量衰减可能是由漏气导致的液态锂溶液的恶化造成的。首周库仑效率相对较低,为81.05%,但从第3个循环开始增加到99%以上,并一直保持到第96个循环。图5i显示了不同倍率下的可逆放电容量(在0.1C、0.2 C、0.5 C、1 C和2 C时分别为133、122、106、88和56 mAh g-1),并且当回到0.1C时将138 mAh g-1的高容量恢复。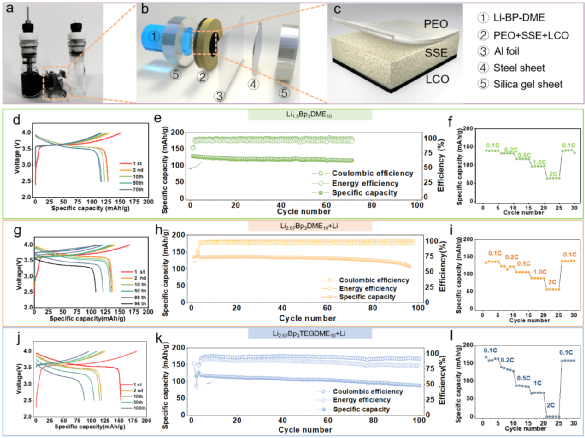 图5 | (a-c) 用于电化学测试的全电池结构的照片和示意图。(d-f)LCO/LPSC@PEO/Li1.5BP3DME10 电池在室温下的电化学性能。(d) LCO/LPSC@PEO/Li1.5BP3DME10 电池的充电-放电曲线。(e) LCO/LPSC@PEO/Li1.5BP3DME10 电池在0.1C下的循环性能。(f) LCO/LPSC@PEO/ Li1.5BP3DME10 电池的倍率性能。(g-i) LCO/LPSC@PEO/(Li2.67BP3DME10+Li负极)电池在室温下的电化学性能。(g) LCO/LPSC@PEO/( Li2.67BP3DME10+Li负极)电池的充放电曲线。(h)LCO/LPSC@PEO/( Li2.67BP3DME10+Li负极)电池在0.1C的循环性能。(i) LCO/LPSC@PEO/( Li2.67BP3DME10+Li负极)电池的倍率性能。(j-l)LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li负极)电池在室温下的电化学性能。(j) LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li阳极)电池的充放电曲线。(k) LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li负极)电池在0.1C的循环性能。(l) LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li阳极)电池的倍率性能。同样,在室温下研究了使用饱和液体锂溶液和固体锂片(Li2.67BP3TEGDME10+Li)的全电池。TEGDME的挥发性比二甲醚低,并且比二甲醚(闪点20℃,沸点83℃)具有更高的闪点(141℃)以及沸点(276℃)。因此,循环的稳定性将得到改善。图5j显示了(Li2.67BP3TEGDME10+Li)电池在第1、2、10、50和100次循环时的充放电曲线。首周的比容量为153.4 mAh g-1,超过了LCO的理论比容量(140 mAh g-1)。由于充/放电电压平台是~3.5V,小于LCO对Li+/Li的电压(3.9V),真正起作用的负极实际上是Li2.67BP3TEGDME10而不是金属锂。图5k显示了100次循环后75.51%的容量保持率。与(Li2.67BP3DME10+Li)电池相比,没有观察到突然的容量下降,反映出良好的循环稳定性。最初的库仑/能量效率为84.44%/83.81%,直到第100次循环,库仑/能量效率稳定(超过92%/80%)。图5l显示了不同电流率下的可逆放电容量(在0.1C、0.2C、0.5C、1C和2C时分别为158、133、86、67和~0 mAh g-1),以及回到0.1C的可恢复容量157 mAh g-1。倍率性能比Li1.5BP3DME10和Li2.67BP3DME10+Li电池差,因为Li2.67BP3TEGDME10的离子传导性比Li1.5BP3DME10和Li2.67BP3DME10低。总之,室温下的饱和(Li2.67BP3(TEG)DME10)和不饱和液态锂溶液(Li1.5BP3DME10)都可以单独作为负极组装电池,具有良好的循环稳定性和良好的倍率性能。锂金属液体电解质电池和液体锂负极(Li-BP-(TEG)DME)电池在不同温度(-20℃、30℃、50℃)下的充放电曲线进行了比较,见图6a-6c。尽管两个电池系统的比容量相似,但无论温度如何,Li-BP-(TEG)DME电池的首周循环库仑效率远远高于锂金属液体电解质电池。这主要是由于锂金属液态电解质电池在首周循环中由于SEI的形成和液态电解质的分解而大量消耗锂离子造成的。相反,由于高度可逆的负极材料和稳定的界面,这种情况不会发生在Li-BP-(TEG)DME电池中。为了更好地进行比较,图6d展示了两个电池系统在不同温度下的首周容量和首周库仑效率。该电池系统可以在较宽的温度范围(-20℃~50℃)内工作。图6e显示了Li1.5BP3DME10(-20℃~30℃)和Li2.67BP3TEGDME10(50℃)电池的充电-放电曲线。在50℃使用TEGDME的原因是为了减少液态锂溶液在高温下的挥发,保证电池的正常工作。这些电池在不同温度下的首周可逆放电容量和首周库仑效率总结在图6f中。由于硫化物SE、PEO界面保护层和液态锂溶液的离子电导率随着温度的升高而增加,电池的阻抗随着温度的升高而降低。可逆放电容量随着温度的升高而增加(从63.9 mAh g-1到138.9 mAh g-1),到30℃时接近LCO的理论比容量(140 mAh g-1)。电池的首周库伦效率随着温度的升高而增加(从70.5%到84.1%)。还研究了Li1.5BP3DME10电池在宽温度范围内(-20℃~30℃)的倍率性能(图6g),图6h中总结了0.1C、0.2C、0.5C、1C和2C时的可逆放电容量。结果表明,在室温(30℃)下,电池的倍率性能较好,在2 C时,容量保持在64.2 mAh g-1。当温度下降到5℃时,电池只能在小于0.5 C的电流速率下工作,在这个温度下(0.5 C)容量为45 mAh g-1。如果温度进一步下降到0℃以下,电池只能以低于0.2C的倍率工作。然而,值得注意的是,电池在-20℃时,0.1C仍然可以稳定地循环,放电容量相对较高,达到79.4 mAh g-1。这表明Li1.5BP3DME10电池系统可以在较宽的温度范围(-20℃~50℃)内工作,适合于各种应用场景。
图5 | (a-c) 用于电化学测试的全电池结构的照片和示意图。(d-f)LCO/LPSC@PEO/Li1.5BP3DME10 电池在室温下的电化学性能。(d) LCO/LPSC@PEO/Li1.5BP3DME10 电池的充电-放电曲线。(e) LCO/LPSC@PEO/Li1.5BP3DME10 电池在0.1C下的循环性能。(f) LCO/LPSC@PEO/ Li1.5BP3DME10 电池的倍率性能。(g-i) LCO/LPSC@PEO/(Li2.67BP3DME10+Li负极)电池在室温下的电化学性能。(g) LCO/LPSC@PEO/( Li2.67BP3DME10+Li负极)电池的充放电曲线。(h)LCO/LPSC@PEO/( Li2.67BP3DME10+Li负极)电池在0.1C的循环性能。(i) LCO/LPSC@PEO/( Li2.67BP3DME10+Li负极)电池的倍率性能。(j-l)LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li负极)电池在室温下的电化学性能。(j) LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li阳极)电池的充放电曲线。(k) LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li负极)电池在0.1C的循环性能。(l) LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li阳极)电池的倍率性能。同样,在室温下研究了使用饱和液体锂溶液和固体锂片(Li2.67BP3TEGDME10+Li)的全电池。TEGDME的挥发性比二甲醚低,并且比二甲醚(闪点20℃,沸点83℃)具有更高的闪点(141℃)以及沸点(276℃)。因此,循环的稳定性将得到改善。图5j显示了(Li2.67BP3TEGDME10+Li)电池在第1、2、10、50和100次循环时的充放电曲线。首周的比容量为153.4 mAh g-1,超过了LCO的理论比容量(140 mAh g-1)。由于充/放电电压平台是~3.5V,小于LCO对Li+/Li的电压(3.9V),真正起作用的负极实际上是Li2.67BP3TEGDME10而不是金属锂。图5k显示了100次循环后75.51%的容量保持率。与(Li2.67BP3DME10+Li)电池相比,没有观察到突然的容量下降,反映出良好的循环稳定性。最初的库仑/能量效率为84.44%/83.81%,直到第100次循环,库仑/能量效率稳定(超过92%/80%)。图5l显示了不同电流率下的可逆放电容量(在0.1C、0.2C、0.5C、1C和2C时分别为158、133、86、67和~0 mAh g-1),以及回到0.1C的可恢复容量157 mAh g-1。倍率性能比Li1.5BP3DME10和Li2.67BP3DME10+Li电池差,因为Li2.67BP3TEGDME10的离子传导性比Li1.5BP3DME10和Li2.67BP3DME10低。总之,室温下的饱和(Li2.67BP3(TEG)DME10)和不饱和液态锂溶液(Li1.5BP3DME10)都可以单独作为负极组装电池,具有良好的循环稳定性和良好的倍率性能。锂金属液体电解质电池和液体锂负极(Li-BP-(TEG)DME)电池在不同温度(-20℃、30℃、50℃)下的充放电曲线进行了比较,见图6a-6c。尽管两个电池系统的比容量相似,但无论温度如何,Li-BP-(TEG)DME电池的首周循环库仑效率远远高于锂金属液体电解质电池。这主要是由于锂金属液态电解质电池在首周循环中由于SEI的形成和液态电解质的分解而大量消耗锂离子造成的。相反,由于高度可逆的负极材料和稳定的界面,这种情况不会发生在Li-BP-(TEG)DME电池中。为了更好地进行比较,图6d展示了两个电池系统在不同温度下的首周容量和首周库仑效率。该电池系统可以在较宽的温度范围(-20℃~50℃)内工作。图6e显示了Li1.5BP3DME10(-20℃~30℃)和Li2.67BP3TEGDME10(50℃)电池的充电-放电曲线。在50℃使用TEGDME的原因是为了减少液态锂溶液在高温下的挥发,保证电池的正常工作。这些电池在不同温度下的首周可逆放电容量和首周库仑效率总结在图6f中。由于硫化物SE、PEO界面保护层和液态锂溶液的离子电导率随着温度的升高而增加,电池的阻抗随着温度的升高而降低。可逆放电容量随着温度的升高而增加(从63.9 mAh g-1到138.9 mAh g-1),到30℃时接近LCO的理论比容量(140 mAh g-1)。电池的首周库伦效率随着温度的升高而增加(从70.5%到84.1%)。还研究了Li1.5BP3DME10电池在宽温度范围内(-20℃~30℃)的倍率性能(图6g),图6h中总结了0.1C、0.2C、0.5C、1C和2C时的可逆放电容量。结果表明,在室温(30℃)下,电池的倍率性能较好,在2 C时,容量保持在64.2 mAh g-1。当温度下降到5℃时,电池只能在小于0.5 C的电流速率下工作,在这个温度下(0.5 C)容量为45 mAh g-1。如果温度进一步下降到0℃以下,电池只能以低于0.2C的倍率工作。然而,值得注意的是,电池在-20℃时,0.1C仍然可以稳定地循环,放电容量相对较高,达到79.4 mAh g-1。这表明Li1.5BP3DME10电池系统可以在较宽的温度范围(-20℃~50℃)内工作,适合于各种应用场景。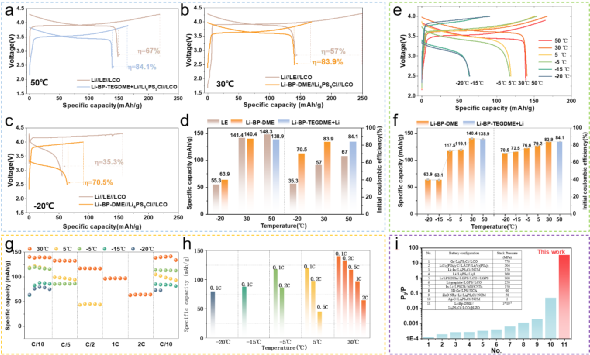 图6 | (a-c) LCO/LE/Li, LCO/LPSC@PEO/Li1.5BP3DME10 和LCO/LPSC@PEO/(Li2.67BP3TEGDME10+Li负极)在50°C, 30°C, -20°C的初始充放电曲线,倍率为0.1 C。(d)三种电池在不同温度(-20℃,30℃,50℃)下的第一周期库仑效率和比容量的总结和比较。(e)不同温度(-20℃~30℃)下LCO/LPSC@PEO/ Li1.5BP3DME10 电池和50℃下LCO/LPSC@PEO/(Li2.67BP3TEGDME10+Li负极)电池的首周充电-放电曲线。(f) LCO/LPSC@PEO/ Li1.5BP3DME10 和 LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li 负极)电池在不同温度(-20°C, -15°C, -5°C, 5°C, 30°C, 50°C)下的首周库仑效率和比容量的总结和比较。(g-h) LCO/LPSC@PEO/ Li1.5BP3DME10 的倍率性能(0. 1 C-2 C)的LCO/LPSC@PEO/ Li1.5BP3DME10 电池在宽温度范围内(-20°C-30°C)。(i)LCO/LPSC@PEO/ Li1.5BP3DME10 电池与以前报道的基于无机固体电解质的全固态电池的外部压力比较(P0为标准大气压力101.325 kPa)。更值得注意的是,液态锂电池在环境操作条件下(即室温下可忽略的3 kPa的外部压力,由一个专门设计的装置测量,如图S7所示)表现出稳定的循环性能。考虑到许多报道的全固态电池所需的高压/高温条件,液体锂电池的环境操作是非常令人印象深刻的(图6i)。最后,这项工作的结果与以前报道的所有室温下的液体碱金属溶液电池进行了比较。图7a显示了上述所有电池的首周放电曲线,其中其他电池系统的放电电压平台都低于本工作中的Li-BP-DME/LPSC/LCO电池系统。图7b总结了这些电池系统的放电平台电压,与其他电池系统(1.8V至3.0V)相比,本工作中报告的新电池系统(Li-BP-DME/LPSC/LCO)显示出最高的放电平台电压(3.6V)。图7c-d总结和比较了采用固体正极材料(Li-BP-DME/LATP/LFP、Li-BP-TEGDME/PVDF/LFP和Li-BP-DME/LPSC/LCO)的Li-BP-(TEG)DME电池的电化学性能(包括能量效率、库伦效率和比容量)。本工作中的Li-BP-DME/LPSC/LCO电池系统在循环稳定性、库仑效率和能量效率方面远远优于其他两个电池系统。Li-BP-DME/LPSC/LCO电池可以稳定地循环约100次,而其他两个电池系统只能循环20次。Li-BP-DME/LPSC/LCO的库仑效率在99%以上,能量效率在96%以上,而Li-BP-TEGDME/PVDF/LFP电池的库仑效率为90%,能量效率低,只有60%。因此,本工作中的电池在迄今为止报道的所有使用固体正极的液体锂电池系统中具有最好的循环稳定性、最高的库仑效率和最高的能量效率。此外,与使用硫化物SE、LCO正极、锂负极/锂合金/LTO负极的全固态电池相比,本工作中的电池在循环稳定性和放电容量方面也表现出明显的优势(图S8)。图7 | (a) 不同电池与液态碱金属溶液的放电曲线。(b) 各种电池与液态碱金属溶液的放电电压平台的比较。(c) 带有固体正极的Li-BP-DME/LATP/LFP、Li-BP-TEGDME/PVDF/LFP、Li-BP-DME/LPSC/LCO的液体锂电池的循环性能。 (d) 带有固体正极的Li-BP-DME/LATP/LFP、Li-BP-TEGDME/PVDF/LFP、Li-BP-DME/LPSC/LCO的循环圈数、库伦效率和能量效率的比较。总之,这里提出了一个创新的电池系统/配置,将硫化物SE(在所有SE中具有最高的室温离子电导率和理想的机械延展性,只需通过冷压就能实现完全压实层)、固体正极LCO和液体金属锂溶液(根本上抑制了锂枝晶的成核和生长)的优点结合起来。该电池可以在可忽略的外部压力(3kPa)下运行,并在宽温度范围(-20~50℃)内表现出良好的性能。此外,在30°C下运行时,实现了高可逆放电容量(140.4 mAh/g)和高效率(99.7 %的库仑效率和约100次循环后>96 %的能量效率)。这种电池配置在迄今为止报道的所有使用固体正极的液体锂溶液电池系统中具有最佳的循环稳定性、最高的库仑效率和最高的能量效率。总的来说,这类电池配置可以为高能量密度、低成本和安全的可充电锂电池开辟一条有前途的道路。彭健,男,本科毕业于东北师范大学,硕士毕业于北京交通大学,目前中科院物理所博士三年级在读。研究方向为新型电极材料与新型硫化物固态电解质材料及电池研究。伍登旭,男,本科毕业于北京理工大学化学与化工学院,现为中科院物理所硕士二年级研究生。主要研究方向为硫化物固态电解质及其界面问题。李泓:中科院物理所博士生导师。北京凝聚态物理国家实验室副主任。科技部先进能源领域储能子领域主题专家,工信部智能电网技术与装备重点专项项目责任专家,国家新能源汽车创新中心技术专家。国家杰出青年科学基金获得者。国家重点研发计划新能源汽车试点专项动力电池项目,北京市科委固态电池重点项目,国家自然科学基金委固态电池重点项目负责人。联合创办北京卫蓝新能源科技有限公司、溧阳天目先导电池材料科技有限公司、中科海钠科技有限公司、天目湖先进储能技术研究院有限公司,长三角物理研究中心有限公司。主要研究领域包括:高能量密度锂离子电池、固态锂电池、电池失效分析、固体离子学。合作发表SCI论文380篇,引用超过27000次,H因子84。共申请中国发明专利100余项,已获授权中国发明专利50余项。陈立泉:中科院物理所博士生导师。中国工程院院士。长三角物理研究中心名誉主任。北京星恒电源股份有限公司技术总监。曾任亚洲固体离子学会副主席,中国材料研究学会副理事长,2004年至今任中国硅酸盐学会副理事长。主要从事锂电池及相关材料研究,在中国首先研制成功锂离子电池,解决了锂离子电池规模化生产的科学、技术与工程问题,实现了锂离子电池的产业化。近年来,开展了全固态锂电池、锂硫电池、锂空气电池、室温钠离子电池等研究,为开发下一代动力电池和储能电池奠定了基础。曾获国家自然科学奖一等奖、中科院科技进步奖特等奖和二等奖,2007年获国际电池材料协会终身成就奖。2001年当选为中国工程院院士。吴凡:中科院物理所博士生导师。发表SCI论文70篇,申请中国、美国、国际发明专利42项。兼任中国科学院大学教授、长三角物理研究中心科学家工作室主任。入选国家海外高层次人才引进计划、中科院海外杰出人才引进计划及择优支持、江苏省杰出青年基金。获全国未来储能技术挑战赛一等奖; 全国青年岗位能手(共青团中央);中国科学院物理研究所科技新人奖;江苏青年五四奖章;江苏青年双创英才;江苏青年U35攀峰奖;常州市五一劳动奖章; 常州市突出贡献人才;常州市十大杰出青年;常州市十大科技新锐;华为优秀创新人才奖及创新探索团队奖;年度新能源领域最受关注研究工作等。任中国能源学会副主任;中国共产党江苏省党代会党代表;中国青科协会员;江苏省青科协理事;常州市青联常委等。
图6 | (a-c) LCO/LE/Li, LCO/LPSC@PEO/Li1.5BP3DME10 和LCO/LPSC@PEO/(Li2.67BP3TEGDME10+Li负极)在50°C, 30°C, -20°C的初始充放电曲线,倍率为0.1 C。(d)三种电池在不同温度(-20℃,30℃,50℃)下的第一周期库仑效率和比容量的总结和比较。(e)不同温度(-20℃~30℃)下LCO/LPSC@PEO/ Li1.5BP3DME10 电池和50℃下LCO/LPSC@PEO/(Li2.67BP3TEGDME10+Li负极)电池的首周充电-放电曲线。(f) LCO/LPSC@PEO/ Li1.5BP3DME10 和 LCO/LPSC@PEO/( Li2.67BP3TEGDME10+Li 负极)电池在不同温度(-20°C, -15°C, -5°C, 5°C, 30°C, 50°C)下的首周库仑效率和比容量的总结和比较。(g-h) LCO/LPSC@PEO/ Li1.5BP3DME10 的倍率性能(0. 1 C-2 C)的LCO/LPSC@PEO/ Li1.5BP3DME10 电池在宽温度范围内(-20°C-30°C)。(i)LCO/LPSC@PEO/ Li1.5BP3DME10 电池与以前报道的基于无机固体电解质的全固态电池的外部压力比较(P0为标准大气压力101.325 kPa)。更值得注意的是,液态锂电池在环境操作条件下(即室温下可忽略的3 kPa的外部压力,由一个专门设计的装置测量,如图S7所示)表现出稳定的循环性能。考虑到许多报道的全固态电池所需的高压/高温条件,液体锂电池的环境操作是非常令人印象深刻的(图6i)。最后,这项工作的结果与以前报道的所有室温下的液体碱金属溶液电池进行了比较。图7a显示了上述所有电池的首周放电曲线,其中其他电池系统的放电电压平台都低于本工作中的Li-BP-DME/LPSC/LCO电池系统。图7b总结了这些电池系统的放电平台电压,与其他电池系统(1.8V至3.0V)相比,本工作中报告的新电池系统(Li-BP-DME/LPSC/LCO)显示出最高的放电平台电压(3.6V)。图7c-d总结和比较了采用固体正极材料(Li-BP-DME/LATP/LFP、Li-BP-TEGDME/PVDF/LFP和Li-BP-DME/LPSC/LCO)的Li-BP-(TEG)DME电池的电化学性能(包括能量效率、库伦效率和比容量)。本工作中的Li-BP-DME/LPSC/LCO电池系统在循环稳定性、库仑效率和能量效率方面远远优于其他两个电池系统。Li-BP-DME/LPSC/LCO电池可以稳定地循环约100次,而其他两个电池系统只能循环20次。Li-BP-DME/LPSC/LCO的库仑效率在99%以上,能量效率在96%以上,而Li-BP-TEGDME/PVDF/LFP电池的库仑效率为90%,能量效率低,只有60%。因此,本工作中的电池在迄今为止报道的所有使用固体正极的液体锂电池系统中具有最好的循环稳定性、最高的库仑效率和最高的能量效率。此外,与使用硫化物SE、LCO正极、锂负极/锂合金/LTO负极的全固态电池相比,本工作中的电池在循环稳定性和放电容量方面也表现出明显的优势(图S8)。图7 | (a) 不同电池与液态碱金属溶液的放电曲线。(b) 各种电池与液态碱金属溶液的放电电压平台的比较。(c) 带有固体正极的Li-BP-DME/LATP/LFP、Li-BP-TEGDME/PVDF/LFP、Li-BP-DME/LPSC/LCO的液体锂电池的循环性能。 (d) 带有固体正极的Li-BP-DME/LATP/LFP、Li-BP-TEGDME/PVDF/LFP、Li-BP-DME/LPSC/LCO的循环圈数、库伦效率和能量效率的比较。总之,这里提出了一个创新的电池系统/配置,将硫化物SE(在所有SE中具有最高的室温离子电导率和理想的机械延展性,只需通过冷压就能实现完全压实层)、固体正极LCO和液体金属锂溶液(根本上抑制了锂枝晶的成核和生长)的优点结合起来。该电池可以在可忽略的外部压力(3kPa)下运行,并在宽温度范围(-20~50℃)内表现出良好的性能。此外,在30°C下运行时,实现了高可逆放电容量(140.4 mAh/g)和高效率(99.7 %的库仑效率和约100次循环后>96 %的能量效率)。这种电池配置在迄今为止报道的所有使用固体正极的液体锂溶液电池系统中具有最佳的循环稳定性、最高的库仑效率和最高的能量效率。总的来说,这类电池配置可以为高能量密度、低成本和安全的可充电锂电池开辟一条有前途的道路。彭健,男,本科毕业于东北师范大学,硕士毕业于北京交通大学,目前中科院物理所博士三年级在读。研究方向为新型电极材料与新型硫化物固态电解质材料及电池研究。伍登旭,男,本科毕业于北京理工大学化学与化工学院,现为中科院物理所硕士二年级研究生。主要研究方向为硫化物固态电解质及其界面问题。李泓:中科院物理所博士生导师。北京凝聚态物理国家实验室副主任。科技部先进能源领域储能子领域主题专家,工信部智能电网技术与装备重点专项项目责任专家,国家新能源汽车创新中心技术专家。国家杰出青年科学基金获得者。国家重点研发计划新能源汽车试点专项动力电池项目,北京市科委固态电池重点项目,国家自然科学基金委固态电池重点项目负责人。联合创办北京卫蓝新能源科技有限公司、溧阳天目先导电池材料科技有限公司、中科海钠科技有限公司、天目湖先进储能技术研究院有限公司,长三角物理研究中心有限公司。主要研究领域包括:高能量密度锂离子电池、固态锂电池、电池失效分析、固体离子学。合作发表SCI论文380篇,引用超过27000次,H因子84。共申请中国发明专利100余项,已获授权中国发明专利50余项。陈立泉:中科院物理所博士生导师。中国工程院院士。长三角物理研究中心名誉主任。北京星恒电源股份有限公司技术总监。曾任亚洲固体离子学会副主席,中国材料研究学会副理事长,2004年至今任中国硅酸盐学会副理事长。主要从事锂电池及相关材料研究,在中国首先研制成功锂离子电池,解决了锂离子电池规模化生产的科学、技术与工程问题,实现了锂离子电池的产业化。近年来,开展了全固态锂电池、锂硫电池、锂空气电池、室温钠离子电池等研究,为开发下一代动力电池和储能电池奠定了基础。曾获国家自然科学奖一等奖、中科院科技进步奖特等奖和二等奖,2007年获国际电池材料协会终身成就奖。2001年当选为中国工程院院士。吴凡:中科院物理所博士生导师。发表SCI论文70篇,申请中国、美国、国际发明专利42项。兼任中国科学院大学教授、长三角物理研究中心科学家工作室主任。入选国家海外高层次人才引进计划、中科院海外杰出人才引进计划及择优支持、江苏省杰出青年基金。获全国未来储能技术挑战赛一等奖; 全国青年岗位能手(共青团中央);中国科学院物理研究所科技新人奖;江苏青年五四奖章;江苏青年双创英才;江苏青年U35攀峰奖;常州市五一劳动奖章; 常州市突出贡献人才;常州市十大杰出青年;常州市十大科技新锐;华为优秀创新人才奖及创新探索团队奖;年度新能源领域最受关注研究工作等。任中国能源学会副主任;中国共产党江苏省党代会党代表;中国青科协会员;江苏省青科协理事;常州市青联常委等。
吴凡特聘研究员带领其科研团队入驻长三角物理研究中心,热诚欢迎博士后、博士研究生、工程师报考/加入课题组(https://www.x-mol.com/groups/wu_fan/people/8037)。来信请联系:fwu@iphy.ac.cn。
 锂金属由于有最低的电化学电位(0V vs. Li/Li+)和超高的理论容量(3861 mAh/g)而被认为是“圣杯”负极(即锂金属负极)。然而,当与易燃液体电解液(LEs)结合时,存在循环效率差、SEI层重复形成、锂枝晶成核/生长和安全问题。用固体电解质(SEs)替代LEs理论上可以解决安全问题,但界面接触不良和严重的界面反应会大大降低使用无机SEs的全固态锂电池(ASSLBs)的性能。而且,在ASSLBs中,为了改善锂金属阳极与SEs的界面接触,往往需要超高的外部压力,不适合大规模生产和实际应用。
锂金属由于有最低的电化学电位(0V vs. Li/Li+)和超高的理论容量(3861 mAh/g)而被认为是“圣杯”负极(即锂金属负极)。然而,当与易燃液体电解液(LEs)结合时,存在循环效率差、SEI层重复形成、锂枝晶成核/生长和安全问题。用固体电解质(SEs)替代LEs理论上可以解决安全问题,但界面接触不良和严重的界面反应会大大降低使用无机SEs的全固态锂电池(ASSLBs)的性能。而且,在ASSLBs中,为了改善锂金属阳极与SEs的界面接触,往往需要超高的外部压力,不适合大规模生产和实际应用。