吴凡、李泓团队-硫化物固态电池及固态电解质的空气稳定性
来源:原创 | 2022年08月02日
1. 研究背景 随着锂电池在生活中更广泛的应用以及新能源车的大量普及,提高锂电池的安全性和能量密度迫在眉睫。传统有机电解液易燃、易爆、易泄露,给锂电池带来巨大安全隐患。用固态电解质替换有机电解液有望从根本上解决电池安全隐患。在各种固态电解质中,硫化物电解质因具有优异的机械延展性和高离子导电率而被认为是最有前途的固态电解质材料。但其具有电化学窗口窄、与高压阴极和锂金属阳极化学/电化学不相容、空气稳定性差等问题,其中硫化物电解质极差的空气稳定性问题尤为突出。当其暴露于空气中时,会发生有毒气体H2S的产生、电解质结构完全破坏、电化学性能衰减,这导致了硫化物电解质的合成、储存、运输和后处理过程都严重依赖惰性气氛或干燥室,大大增加了生产成本。 本文综述了硫化物电解质在空气稳定性方面的研究历史和取得的突破性进展。首先总结了几种理论以解释硫化物电解质空气不稳定的本质原因,包括适用于玻璃材料的无规则网络理论、基于化学物种亲和作用的软硬酸碱(HSAB)理论、基于水解反应能量变化的热力学分析以及基于晶面反应活性的界面反应动力学。为了更好地理解电解质结构-性能关系,进一步总结了硫化物电解质在空气中稳定性的表征方法,包括H2S的生成量、形态演化、质量变化、组分/结构变化和电化学性能。此外,重点介绍了开发空气稳定的硫化物电解质的有效策略,包括H2S吸收剂、元素替代、新材料设计、表面工程和硫化物-聚合物复合电解质。该文以“Air Stability of Sulfide Solid-state Batteries and Electrolytes”为题发表在国际知名期刊Electrochemical Energy Reviews (IF=32.804)上。通讯作者为中国科学院物理研究所李泓、吴凡研究员,卢普顺、伍登旭为本文共同第一作者。
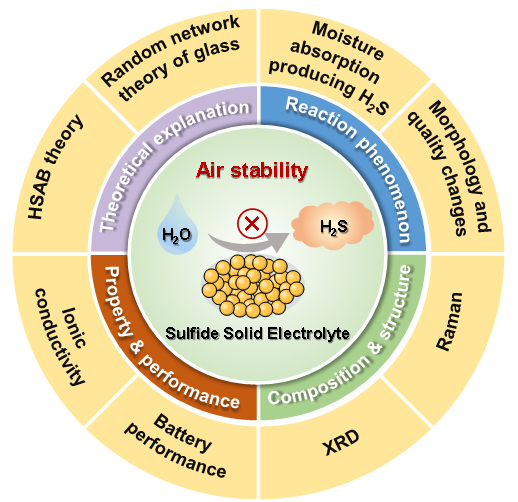
图1硫化物电解质空气稳定性研究框架
最早的工作是由Zachariasen于1932年提出的玻璃无规则网络理论,后来Martin等人在2008年提出通过降低非桥接硫的比例来提高硫化电解质的空气稳定性,硫化电解质的空气稳定性研究开始受到关注。2011年,Tatsumisago等首次研究了玻璃和玻璃陶瓷Li2S-P2S5硫化物在空气中的结构变化。2013年,Hayashi在玻璃态电解质中加入金属氧化物,并通过Li2O部分取代Li2S实现了氧取代成功抑制了H2S气体的生成。随后,基于氧取代策略(如xLi2O·(75−x)Li2S·25P2S5、75Li2S·(25−x)P2S5·xP2O5和Li6PS5−xOxBr)的一系列工作被报道。虽然这种方法能有效地提高空气的稳定性,但也牺牲了离子电导率。2019年,Xiao等进行了Zn、O共取代,得到了空气稳定性和离子导电性显著增强的微晶玻璃电解质。此外,他们还首次计算了共取代硫化物电解质和原始硫化物与水的水解反应的能量变化,进一步证明了该策略的有效性。随后,共掺杂策略也成功地应用于各种硫化电解质(如Li3+3xP1−xZnxS4−xOx、Li6−2xZnxPS5−xOxBr和Li6.988P2.994Nb0.2S10.934O0.6),全面提高了性能。2014年,梁成都等利用Person在1963年提出的软硬酸碱理论(HSAB)理论作为指导获得了在空气稳定和高电导率的As-取代Li4SnS4 (LSS)。基于HSAB理论,一系列新型空气稳定电解质材料被开发出来。2019年,Hayashi等成功合成了空气稳定性更好但离子电导率降低的Li3SbS4。同时,Huang等创造性地合成了具有开放骨架结构和可逆水吸附/解吸能力的Li4Cu8Ge3S12。然而,虽然这些新材料的母相(即LSS、Li3SbS4和Li4Cu8Ge3S12)通常比硫代磷酸盐具有更好的空气稳定性,但离子电导率更低。幸运的是,Li4SnS4家族的各种材料(如Li3.833Sn0.833As0.166S4、0.4LiI−0.6Li4SnS4、Li3.8Sn0.8Sb0.2S4、Li3.85Sn0.85Sb0.15S4)被开发出来并实现了溶液涂膜加工,极大地促进了其实际应用。为了开发适合干室条件的空气稳定硫化物电解质, 2020年孙学良等通过软酸置换得到了Sn取代的Li6PS5I和Sb取代Li10GeP2S12,空气稳定性和离子电导率显著提高。此外,还提出了其他策略,如硫化物-聚合物复合电解质和表面工程,以提高硫化电解质的空气稳定性。此外在2020年,莫一非等基于热力学分析系统研究了不同中心阳离子M的锂三元硫化物Li-M-S的空气稳定性,为设计空气稳定的硫化物电解质提供了指导。
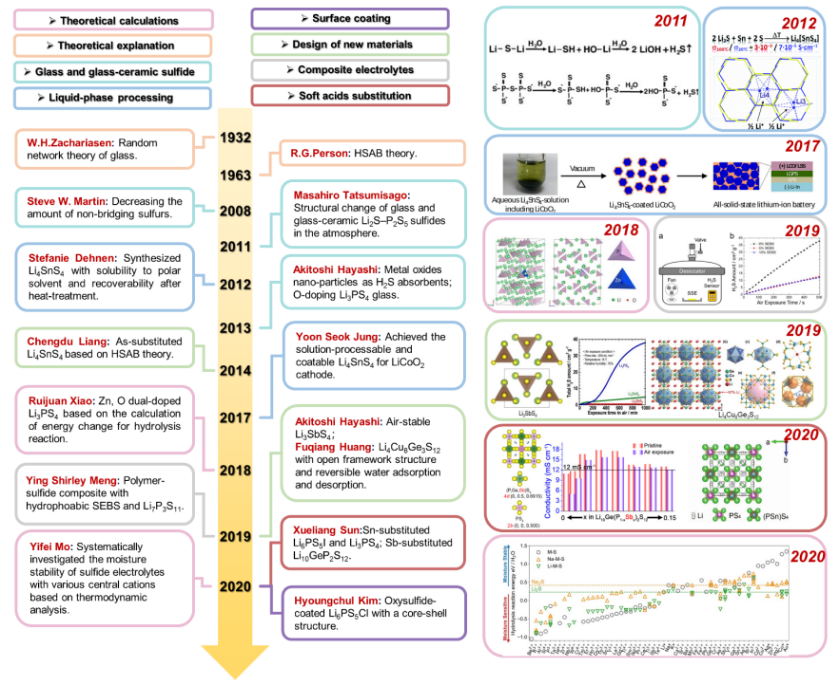
图2 硫化物电解质和全固态电池空气稳定性研究历程
及里程碑式突破
随着对硫化物电解质空气稳定性认识的不断深入,人们从不同的角度提出了各种理论解释,包括玻璃的无规则网络理论、软硬酸碱理论、热力学分析和界面反应动力学等。
3.1 玻璃无规则网络理论
1932年,Zachariasen提出玻璃无规则网络理论(RNTG)来解释玻璃材料中离子多面体(如四面体和八面体)短程有序和长程无序的构造(图3a)。由于早期研究是从玻璃和玻璃陶瓷硫化物电解质开始,故RNTG 成为理论指导。2008年,Martin等人指出非桥连硫阴离子易受水分子攻击,因此通过引入Ga3+和La3+等三价离子将非桥联硫单元桥联,以消除部分非桥联硫,从而提高玻璃的空气稳定性,但该说法缺乏令人信服的实验数据支持。2011年,Muramatsu等人发现 Li2S-P2S5 硫化物电解质的空气稳定性与其局部结构有关。与分别含有P2S74- 和Li-S-Li 基团的67Li2S·33P2S5 玻璃和Li2S晶体相比,含PS43-基团的 75Li2S·25P2S5 玻璃和玻璃陶瓷硫化物表现出最高的空气稳定性。他们得出结论,P2S74-和Li-S-Li中的桥硫首先被水分子攻击并转化为-SH基团,随后与水分子反应,最终转化为H2S气体。在这种情况下,根据实验结果,桥接硫似乎不如非桥接硫稳定。Fukushima发现 60Li2S·25P2S5·10Li3N 玻璃陶瓷硫化物不仅具有高离子电导率,而且对水分具有高稳定性,这归因于通过氮添加在玻璃网络中形成交联。除了比较玻璃体系中各种材料的空气稳定性外,玻璃、玻璃陶瓷和结晶硫化物电解质之间的空气稳定性差异还有待进一步研究。
3.2 软硬酸碱理论
1963年,Pearson在路易斯酸碱理论的基础上提出了硬、软酸碱(HSAB)理论。根据原子、离子和分子对电子的结合能力(从强到弱),化学物种可分为硬、中和软三类。Pearson定义了绝对硬度来计算和量化各种化学物质的硬度。随后,Klopman 在分子轨道理论的基础上进一步阐述了 HSAB 理论。如图3b所示,软碱和酸分别具有较高的最高占据分子轨道(HOMO)和较低的最低未占据分子轨道(LUMO)。它们之间的能量差很小,有利于电子迁移,产生较低能量的混合轨道和强共价键。相反,硬碱和酸分别具有较低的 HOMO 和较高的 LUMO(图 3c)。能量差大,不利于电子迁移。因此,它们更倾向于电离,从而诱导库仑相互作用并形成强离子键。硬化学物质和软化学物质的组合通常会导致弱离子键,从而导致产物不稳定。综上所述,HSAB理论可以用一句话概括:软酸/碱对软碱/酸具有高亲和力,硬酸/碱对硬碱/酸具有高亲和力,这可以通过其产物的高稳定性来证实。2014年,Sahu等人首次提出 HSAB 理论可以作为设计空气稳定硫化物电解质的指南。在此指导下,Sn4+、As5+、Sb5+和其他软酸倾向于与软碱S2−紧密结合以抵抗H2O 的侵蚀,已被用于提高硫化物电解质的空气稳定性。
3.3热力学分析
基于吉布斯能量变化的硫化物电解质与H2O 之间水解反应的热力学分析有助于评估各种硫化物电解质的空气稳定性和筛选潜在的空气稳定候选物。Liu等首先进行了能量变化的计算,以证明 ZnO 掺杂的β-Li3PS4 改善了空气稳定性。最近,Zhu等进行了热力学分析,系统地研究了具有不同中心阳离子 M 的三元硫化锂 Li-M-S 的水稳定性。如图 3d 所示,中心阳离子M 的整体稳定性趋势与HSAB 理论和相关的实验一致,即与含有 B3+、Al3+、Si4+ 和 P5+ 的硫化物相比,具有中心阳离子为Sn4+、Sb5+ 和 As5+ 的硫化物电解质表现出更好的水稳定性。
3.4 界面反应动力学
硫化物电解质与空气或水分之间的化学反应首先发生在它们的界面处,因此有必要研究这种界面反应的动力学。Kim等将S离子的p带中心 (ΔEp) 和S空位的偏析能 (EVS,电解质g) 定义为电子和结构描述符,以基于密度泛函理论评估 β-Li3PS4 的空气不稳定性。在四个暴露的表面(图 3e)中,即(111)、(101)、(001)和(100),(110)和(111)表面被确定为高度不稳定,因为它们的ΔEp和EVS,电解质g,观察到呈现线性关系,如图3f所示。因此,在硫化物电解质的合成过程中,应通过控制暴露的晶面来抑制具有高表面反应性的表面的形成和生长。然而,目前合成的硫化物电解质大多是多晶粉末,具有随机暴露的晶面,偏离 Gibbs-Wulff 定理的平衡晶体形状,仍需进一步发展具有高化学稳定性的暴露晶面从而提高硫化物电解质空气稳定性的方法。随后,Kim 等通过Li7P3S11(100)表面的AIMD模拟发现,表面锂离子上的H2O 吸附-解离反应是硫化物电解质水解反应的初始阶段。然后,他们基于暴露于空气和脱锂的 Li7P3S11 样品的 XPS 结果,发现并验证了空气和电化学劣化之间的相关性,如图 3g 所示。 最近,Xu等人实验研究了结晶度对空气稳定性的影响,他们发现Q-Li9P3S9O3高度结晶的表面为H2O分子的吸附提供了有限数量的缺陷位点,从而减缓了水解反应从表面到体相的传播。
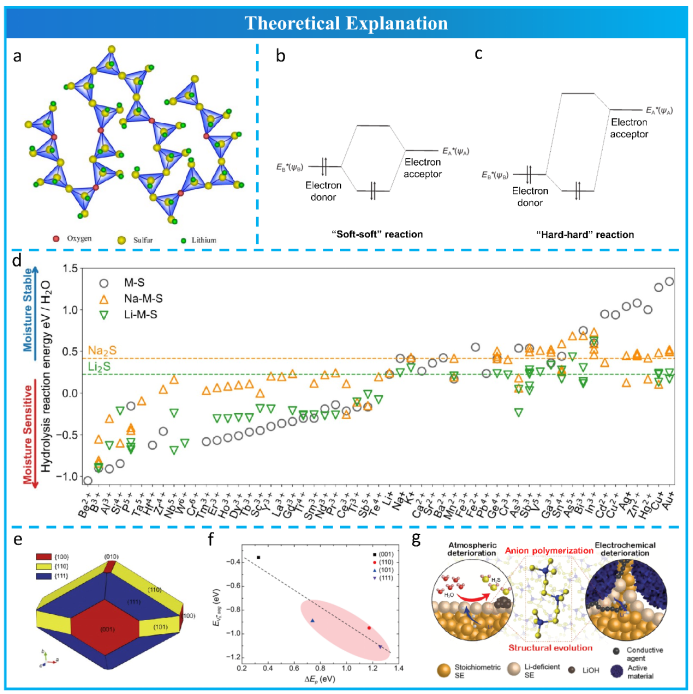
图 3 理论解释。a 玻璃材料的网络结构示意图;b “软-软”反应和 c “硬-硬”反应的HSAB理论示意图;d 具有不同中心阳离子的硫化物的水解反应能;e. β-Li3PS4的暴露晶面(预测);f ΔEp 和EVS,电解质g的线性关系。g 由空气劣化和电化学劣化引起的阴离子聚合示意图。
空气稳定性反映了电解质材料在空气中的化学稳定性。空气稳定的电解质不会与任何空气成分如氮气、氧气、二氧化碳、水分等发生反应。因此,硫化物电解质的空气稳定性表征可以基于宏观化学反应现象(即H2S气体生成量、形貌和质量随暴露时间的变化)、微观化学成分和结构,以及暴露于空气前后的电化学性能(图3)。除了材料研究普遍采用的常用表征方法(如X射线衍射(XRD)、拉曼、X射线光电子能谱(XPS))外,还有一些先进的表征方法,如固态魔角自旋核磁共振(MAS-NMR)和同步辐射源(例如,X射线吸收近边光谱(XANES)和扩展X射线吸收精细结构(EXAFS)),都已应用于硫化物电解质的空气稳定性研究。
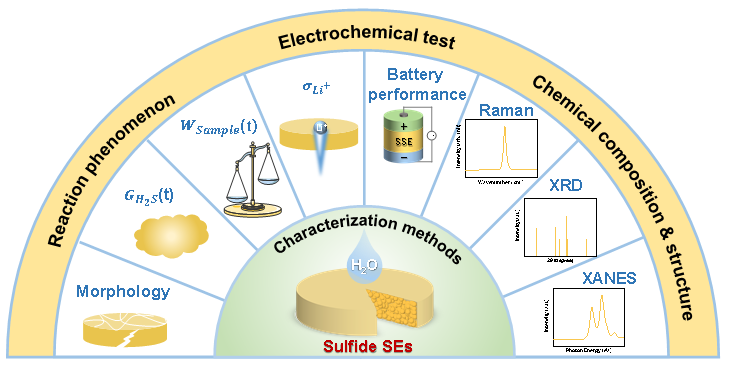
图4 硫化物电解质的空气稳定性表征方法总结
4.1 宏观化学反应现象
硫化物电解质表现出吸湿性,暴露在潮湿空气中会产生有毒的H2S气体,并导致形态和质量的变化。
4.1.1 H2S气体产生量
硫化物电解质暴露于空气中产生的H2S气体量通常被认为是评价其空气稳定性和实际应用可能性的关键指标。如图5a所示,传统的H2S气体产生量测量方法是将硫化物样品放入一定体积的密闭干燥器/容器中,将硫化物样品暴露在温度和相对湿度(RH)预先控制好的气氛中,然后通过气体传感器实时检测和记录H2S气体浓度。H2S气体的总生成量 (V) 可由公式 (1) 计算:
其中 V 表示按硫化物电解质样品的重量m (g)归一化的H2S总生成量 (cm3 g-1),C 表示H2S浓度的记录值 (ppm),L是干燥器

的体积 (cm3)。
然而,H2S气体生成量的准确测量仍面临一些问题。由于干燥器整个空间内H2S气体的不均匀分布,气体传感器检测到的浓度与位置有关。因此,在干燥器中加装了一个小型电风扇,使空气循环(图 5b 和 c),使干燥器内的H2S气体分布大致均匀,使H2S浓度检测值更具代表性。但是,由于瞬间产生的H2S气体随气流循环,直到被气体传感器检测到,仍然存在可能的延时检测。此外,连续水解反应过程中RH的波动可能会影响H2S气体的生成速率。随后,Kimura等通过将硫化物样品暴露在具有恒定 RH 和流速的流动空气中,克服了这一挑战。受此启发,采用泵吸式气体传感器代替基于气体扩散的点检测传感器,整个装置采用管道连接,实现气体单向流动、H2S气体即时检测和恒定RH暴露空气,如图 5d 所示。因此,该设计克服了上述H2S气体准确测量所面临的挑战。H2S的总生成量由式(2)计算。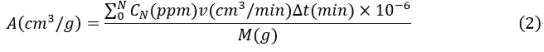
式中A表示硫化物电解质样品中 S 原子的重量 (M) 归一化的H2S的总/累积生成量,CN表示H2S浓度的第N个记录值,v是气流速度,Δt是记录的时间间隔
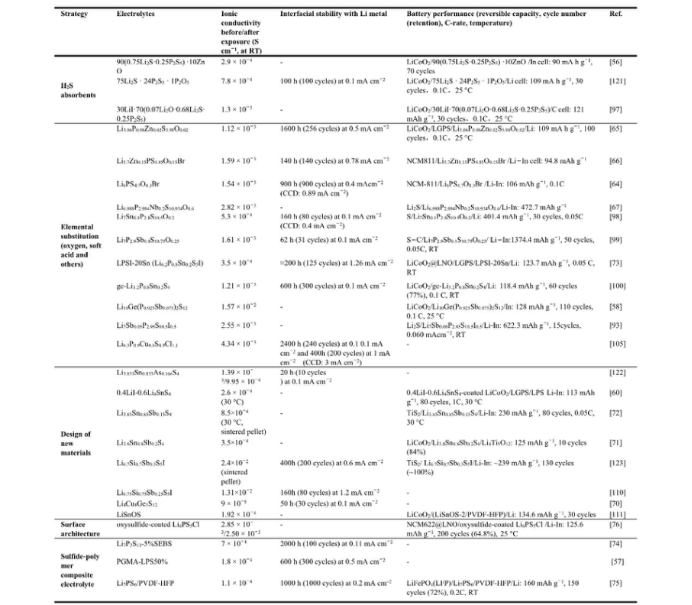
在这篇综述中,从各种硫化物电解质的空气稳定性测试中获得的报告数据总结在表 1 中。改性硫化物电解质改善的空气稳定性可以通过抑制H2S气体的生成量和较轻的结构破坏来证实。从表1可以得出两个明显的结论。硫化物样品与空气的暴露表面积越大,水解反应越激烈,H2S气体的产生量也越大。硫化物样品暴露的相对湿度越高,产生的H2S气体就越多。然而,由于检测系统、暴露条件的差异,很难根据大量报告结果中收集的数据来定量识别各种硫化物电解质之间的空气稳定性差异,因此需要建立统一的H2S气体生成量测量标准,以实现不同实验室数据的可比性。
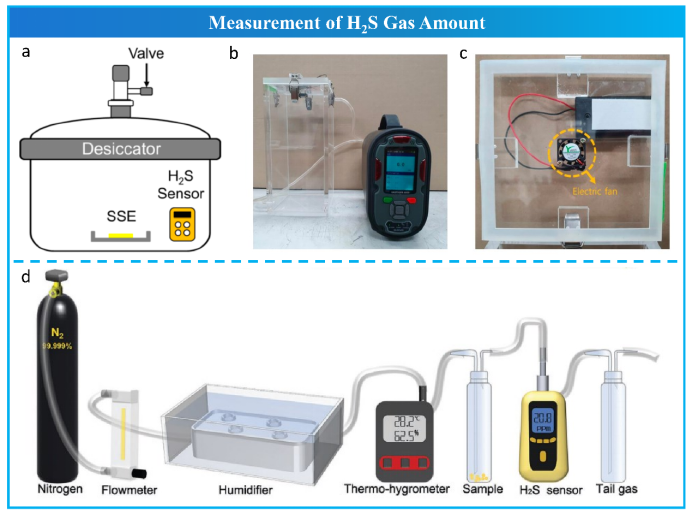
图 5 H2S气体量的测量。a 常规检测系统;b、c 改进的检测系统;d 我们设计的检测系统;
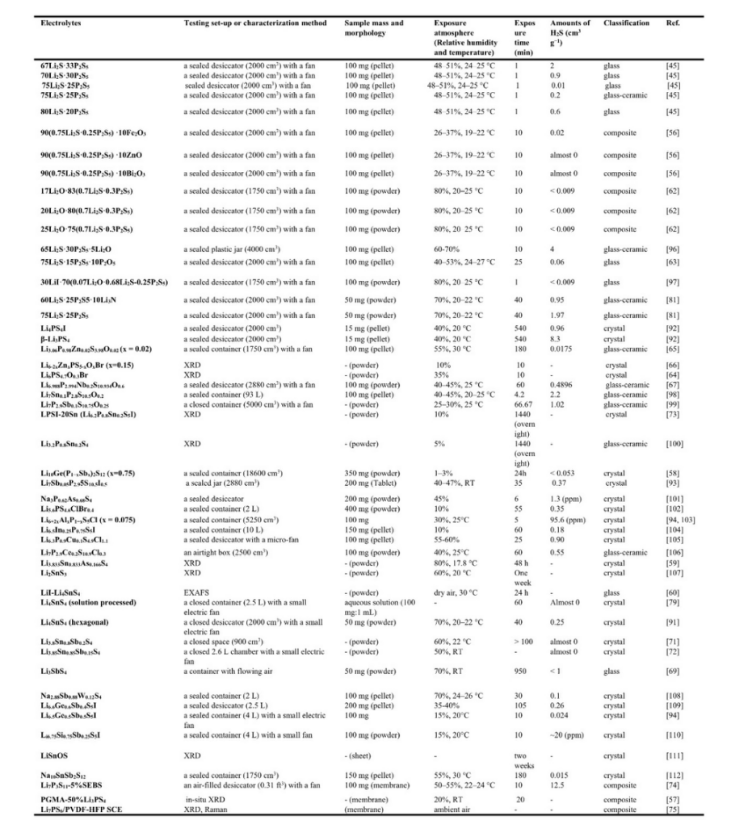
表1 | 硫化物固态电解质的空气稳定性数据
4.1.2 形态和质量的变化
除了产生H2S气体外,水解反应过程中还存在形态和质量变化。最近,卢普顺等记录了 Li9.54Si1.74P1.44S11.7Cl0.3 (LSPSC)、Li3PS4 (LPS)、LSS 和 Li3.875Sn0.875As0.125S4 (LSAS) 粉末暴露于潮湿空气(100% RH ) 的图片。LSPSC和LPS体积变化大,颜色变化明显,而LSS和LSAS只是吸收了H2O分子,变成透明溶液,没有水解反应,如图6a所示。Tufail等进一步研究了Li7P3S11和 Li7Sb0.05P2.95S10.5I0.5片的横截面和表面的非原位 SEM 图像。Li7Sb0.05P2.95S10.5I0.5片的形态在暴露于40-47% 湿度20分钟的湿空气前后未明显变化,而Li7P3S11 则显示出更多的裂纹(图 6b)。许洁茹等在Li6PS5Cl膜表面设计了一个由氟化聚硅氧烷 (FPOS) 包覆的 Li1.4Al0.4Ti1.6(PO4)3 (LATP) 纳米粒子组成的保护表面层。即使在水滴不断滴落的情况下,具有超疏水层的Li6PS5Cl膜能排斥水滴并保持其原始形态,而未改性的Li6PS5Cl膜呈现剧烈的颜色变化,如图 6c 所示。
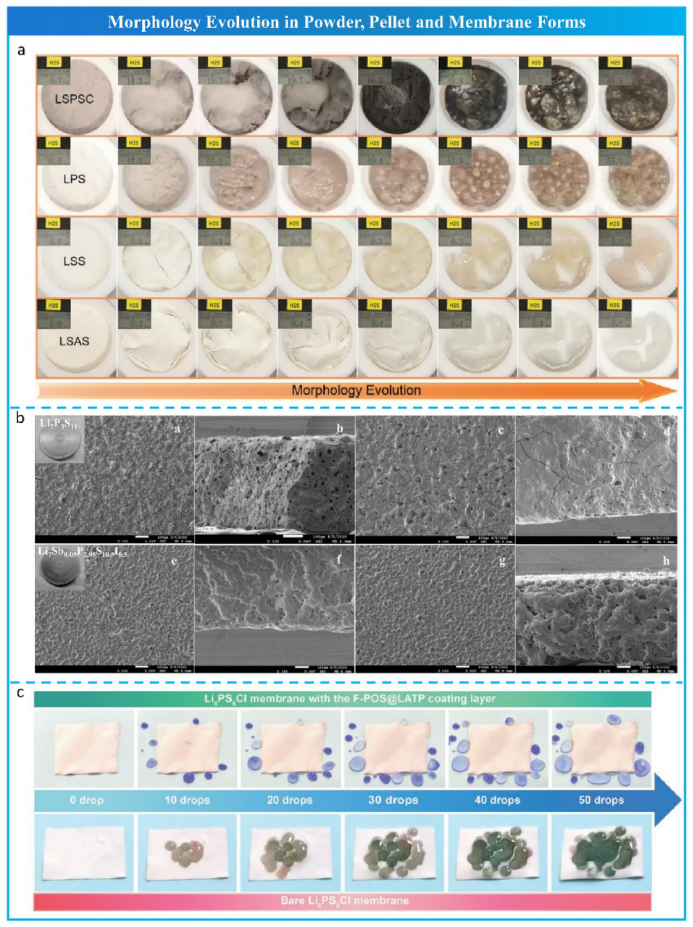
图6 潮湿空气中硫化物电解质的形态演变。a LSPS、LPS、LSS 和 LSAS片;b Li7P3S11 和 Li7Sb0.05P2.95S10.5I0.5 片;c 喷涂和裸露的Li6PS5Cl膜
4.2 微观成分及结构
Muramatsu 等人首先研究了基硫化物电解质在空气中的结构变化和稳定性。他们发现 Li2S-P2S5 玻璃和微晶玻璃电解质的空气稳定性与其局部结构有关,局部结构随Li2S的摩尔比例而变化。如图 7a 所示,H2S的生成量在Li2S摩尔比例为 75% 时达到最小值,然后增加。67Li2S-33P2S5玻璃和Li2S晶体在暴露4分钟、90分钟和1天前后的拉曼光谱如图7b、c所示,他们推测 67Li2S-33P2S5 玻璃中的 P2S74- 基团和Li2S晶体中的 Li-S 基团都经历了两步水解反应(图7f和g),最终生成了桥接硫键断裂后的H2S。相比之下,75Li2S-25P2S5玻璃和微晶玻璃电解质在Li2S-P2S5 硫化物电解质中具有最高的空气稳定性。此外,X 射线衍射 (XRD) 已普遍用于识别各种硫化物电解质在暴露于空气之前和之后的整体晶体结构变化,以及水解反应产物的分析。此外,硫化物电解质在暴露于空气之前和之后的局部结构和化学成分已通过 MAS-NMR、XANES、EXAFS 和 XPS 进行了表征,将在后续章节中详细阐述。
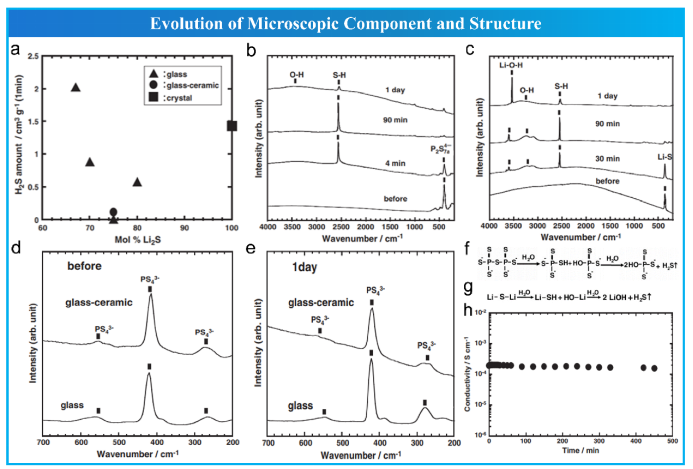
图 7 硫化物电解质微观组分和结构的演变。
4.3电化学性能
硫化物电解质的空气不稳定性导致结构破坏和副产物的形成,这极大地降低了硫化物电解质/全固态电池的电化学性能。在材料层面,硫化物电解质在暴露于潮湿空气后的离子电导率根据其不同的空气稳定性而受到不同程度的降低。暴露于潮湿空气后,空气不稳定的硫化物电解质(例如 Li3PS4、Li6PS5Cl和 LGPS)的离子电导率由于水解反应而显着降低。对于经过改性(例如氧或软酸取代)后对水分子攻击具有一定稳定性的空气不稳定硫化物电解质,由于缓慢且不可逆的水解反应,离子电导率也会降低。相比之下,空气稳定的硫化物电解质(例如 LSS、Li3SbS4)的离子电导率由于吸水而略有降低,但可以通过去除水分子来可逆地恢复。值得注意的是,一些暴露于湿气的材料,如 Li4Cu8Ge3S12和 Li2Sn2S5,甚至具有更高的离子电导率,这可能源于质子的传导或Li+与水分子耦合产生的加速效应,这将在后续章节中讨论。然而,空气暴露后硫化物固态电解质的电子电导率和电化学稳定性尚未得到深入研究。
在全电池水平,由于离子电导率降低和副反应产物产生,电化学性能会恶化。Cho等将沸石作为H2O和H2S气体的清除剂加入到Li6PS5Cl中,以减轻Li6PS5Cl与水分之间的水解反应,其电池性能如图 8a,8b所示。Park等分别使用了暴露在干燥空气 24 小时前后 Li3PS4/LiCoO2 和 0.4LiI-0.6Li4SnS4 涂层的 LiCoO2 正极组装了全固态电池(图 8c)。此外,Liang等报道,空气暴露的Li10Ge(P1-xSbx)2S12的全固态电池的可逆容量(图 8d)仅略微降低。另外有趣的是,Ye 等发现使用空气暴露 1 小时后的Li9.54Si1.74(P1−xSbx)1.44S11.7Cl0.3 (x = 9.7%) 的全固态电池比容量略有提高,并且长循环稳定性甚至优于暴露前(图 8e 和 f)。Lu等报道,与仅湿空气暴露的Li3.875Sn0.875As0.125S4(LSAS)相比经过热处理的全固态电池具有高放电容量和长循环稳定性(图8g和h),可能是由于 LSAS 的可逆水吸附/解吸和微量水产生了有利界面产物。Xu等为Li6PS5Cl膜设计了一种超疏水层,即使在水暴露后也不会牺牲电化学性能(图8i, j)。Li等在环境气氛下制备了 Li7PS6 嵌入复合电解质的空气稳定膜。将利用空气暴露后的该固态电池膜的全固态电池表现出高倍率能力(图 8k),因为聚(偏二氟乙烯-共聚六氟丙烯)(PVDF-HFP)聚合物基质保护 Li7PS6 硫化物电解质免受空气影响。
总之,已经开发了各种表征方法来从不同方面研究硫化物电解质的空气稳定性,包括宏观化学反应现象、微观成分/结构和电化学性质。在这些表征方法中,建议优先采用基本且通用的方法,包括暴露时H2S生成量的测量、晶体结构的 XRD 和局部结构的拉曼光谱以及暴露前后离子电导率的测量。构建不同实验室可比数据的统一评价体系。先进的表征方法,如 XAS、NMR 和原位 TEM,可以作为提供进一步证明和加深理解的方法。
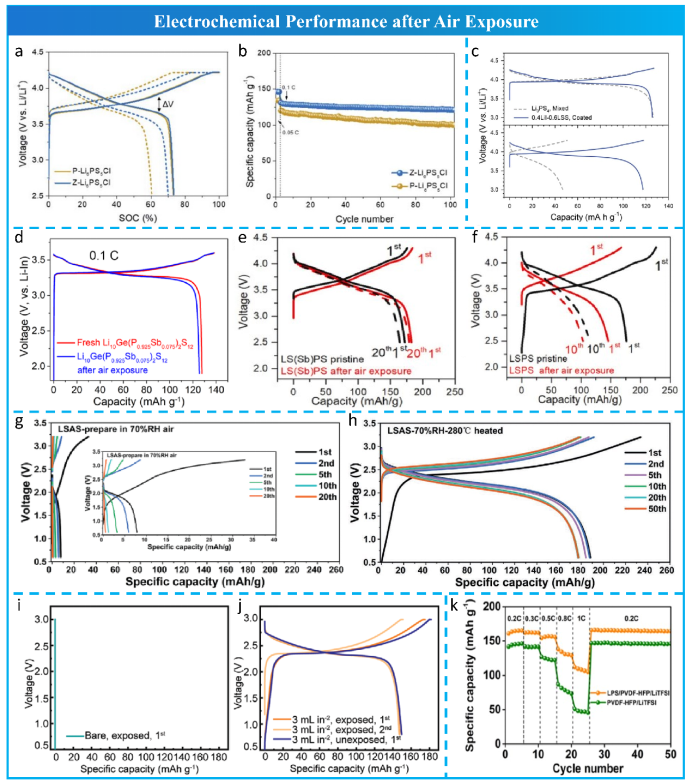
图 8使用空气暴露后的硫化物电解质的全固态电池电化学性能。
经过数十年的研究,已经提出了五种有效的策略(图 9)来提高硫化物电解质的空气稳定性:(1)使用添加剂吸收H2S气体;(2)用氧部分替代 S2-阴离子或利用软酸替代P5+;(3) 设计以软酸为中心阳离子的新材料;(4) 表面涂层或钝化;(5) 构建硫化物-聚合物复合电解质。所有这些策略都被证明可有效减少H2S气体的产生量(表1)。其中,用氧或软酸替代和设计新材料是目前提高硫化物电解质固有空气稳定性的最佳解决方案。构建复合电解质的策略有望整合硫化物和聚合物电解质的优势,从而可能满足电解质材料的所有先决条件并加速全固态电池的商业化。然而,作为H2S吸收剂,金属氧化物添加剂降低了硫化物电解质的离子电导率,且只是通过化学反应消耗 H2S,而不是提高固有的空气稳定性。值得注意的是,为提高空气稳定性而采取的策略通常会引起硫化物电解质的其他关键特性(例如离子电导率和与锂金属的相容性)的变化,如表2所示。
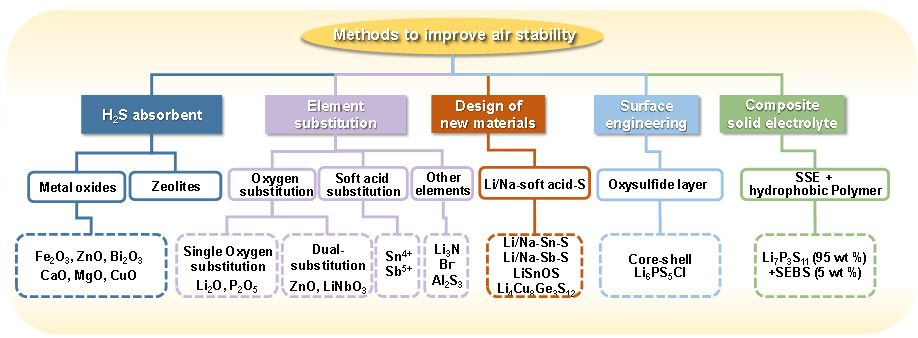
图 9 提高硫化物电解质空气稳定性的方法
表2 | 使用空气稳定的硫化物电解质固态电池的电化学性质
5.1 H2S吸收剂
鉴于 ZnO 与H2S气体反应以充当其吸收剂,Hayashi 等推测金属氧化物MxOy和H2S气体之间的化学反应遵循方程式 (3)。

由于吉布斯自由能的变化应为较大的负值才能有效吸收H2S气体,因此筛选出三种金属氧化物(Fe2O3、ZnO 和 Bi2O3),因为它们的吉布斯自由能变化大(ΔG)(分别为-43.9,-78.0和-232.0 kJ mol-1)。如图 10所示,复合电解质中的Fe2O3、ZnO和Bi2O3均能有效吸收H2S气体,其中Bi2O3具有最佳的吸收效果。但不幸的是,离子电导率随着ZnO的摩尔百分比单调下降。
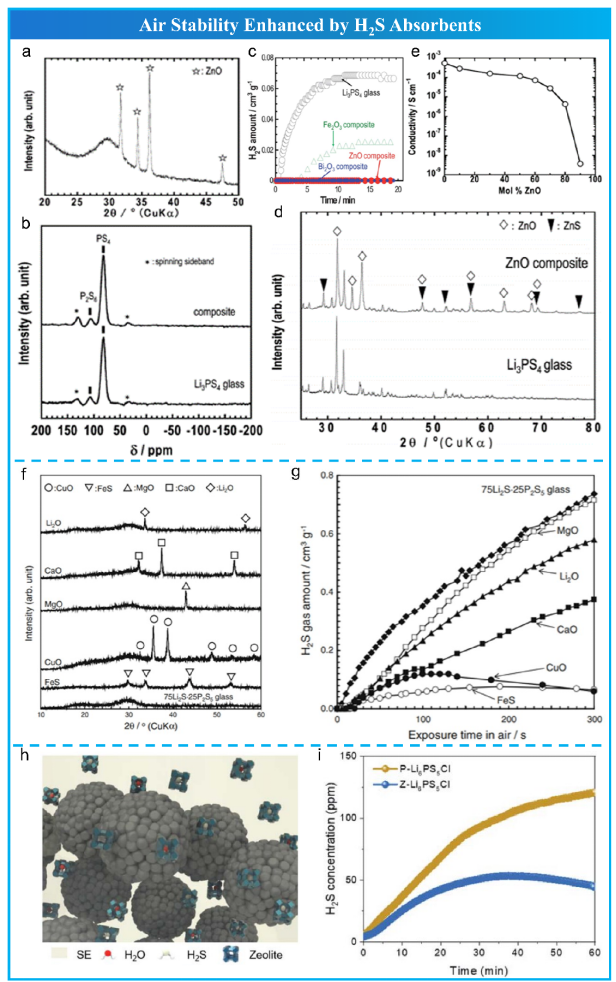
图 10 H2S吸收剂增强空气稳定性。
随后,Hayashi 等在 75Li2S·25P2S5 玻璃中加入 FeS 和碱性金属氧化物(如 Li2O、MgO、CaO 和 CuO),分别催化H2S的分解。如图 10f, g 所示,这些添加剂抑制了H2S气体的产生,抑制效果的顺序为 FeS > CuO > CaO > Li2O > MgO。然而,由于添加了非离子导体,这些复合电解质的离子电导率降低,其中FeS 对H2S气体的产生具有最佳的抑制作用,并且带来的离子电导率损失最小。
除了一些特定的金属氧化物会与H2S甚至H2O发生反应外,一些具有三维多孔结构的材料(如沸石)可以吸收H2O 分子并储存H2S气体。Li等人将煅烧的 ZSM-5 沸石掺入 Li6PS5Cl(Z-Li6PS5Cl)粉末中(图10h,i), 发现H2O和H2S可以被有效地吸附到沸石内部的孔隙中,导致H2S生成率低,随后H2S浓度降低。但是引入锂离子绝缘的沸石必然会降低离子电导率。
总之,通过与硫化物电解质的物理混合引入离子绝缘H2S吸收剂,不可避免地会阻碍离子传导。使用添加剂吸收或催化H2S的分解确实抑制了明显的H2S气体的产生,但不会提高空气稳定性,因为 S 原子与硫化物电解质的分离总是伴随着结构退化/坍塌。鉴于硫化物电解质具有固有的吸湿性和水解倾向,只有为克服这两个挑战而量身定制的改性方法才能从根本上提高硫化物电解质的空气稳定性。
5.2 元素替换
元素替换可分为三种类型。第一种类型是氧取代,它可能通过形成氧硫化物从而结合氧化物电解质的高化学稳定性和硫化物电解质的高离子电导率。第二种是基于 HSAB 理论的软酸取代,它产生强大的 M-S 键以抵抗O2和H2O的攻击。其他具有复杂机制的元素替换属于最后一种类型。
5.2.1 氧取代
Ohtomo等合成xLi2O·(75−x) Li2S·25 P2S5,如图11所示,75 Li2S·25 P2S5玻璃的结构保留从x = 4%到17%没有Li2O衍射峰,当x = 4%时,H2S产气量开始显著下降(图11b)。当x≥7%时,生成的H2S气体浓度达到气体传感器的下限。他们推测,Li2O的引入降低了75Li2S·25P2S5玻璃中残留的Li2S,从而抑制了H2S气体的生成。但75Li2S·25P2S5玻璃的离子电导率随着Li2O的比例x单调降低(图11c)。当x = 7%时为最佳配比,此时xLi2O·(75−x)Li2S·25P2S5具有良好的空气稳定性和离子导电性。最近,Ren等用不同量的Li2O取代Li2S,获得了(70-x)Li2S·30P2S5·xLi2O微晶玻璃。当x = 1%时,1.2×10−3 S cm−1的离子电导率最高;当x = 5%时的水稳定性最好,但离子电导率较低。
遵循相同的氧替代策略,Hayashi等合成了Li2S·(25−x) P2S5·xP2O5(图11 d,e,f)。发现P2O5氧掺杂显著抑制了H2S的生成速率,而不是H2S的总生成量。在0≤x≤10范围内,75Li2S·(25−x)P2S5·xP2O5玻璃的离子电导率也随着P2O5的增加而单调下降,新形成的硫氧单元中的非桥接氧成为锂离子传导的强陷阱。然而,Xu等报道了低浓度(x = 1)掺杂的75Li2S·(25−x)P2S5·xP2O5的离子电导率最大值达到了8 × 10−4 S cm−1。结合Hayashi等人报道的实验结果,他们得出当取代比x = 1时,非桥接硫原子完全被桥接氧原子取代,成为锂离子的弱陷阱,导致离子电导率增加。然而,大量的硫原子被氧原子取代,形成了一系列的硫氧单元,非桥接氧作为锂离子传导的强陷阱,导致离子导电性降低。
此外,Zhang等发现,O掺杂Li6PS5−xOxBr(0≤x≤1)表现出一定的空气稳定性和良好的枝晶抑制能力。与其他O掺杂的硫化物相比,O更倾向于取代自由S2−位置上的S原子,而不是PS43−四面体上的S原子。Peng等通过P2O5部分替代原料P2S5合成了O取代Li5.5PS4.5−xOxCl1.5 (x = 0, 0.075, 0.175, 0.25) 电解质。Li5.5PS4.5−xOxCl1.5的空气稳定性随O含量单调增加,而离子电导率随O含量单调降低。最近,Xu等人合成了Li6.25PS4O1.25Cl0.75,具有对潮湿空气的高稳定性,并通过S和Cl位点上的部分氧取代获得了2.8 mS cm−1的离子电导率。在53%RH湿度条件下Li6.25PS4O1.25Cl0.75结构保持良好。180℃退火后,空气暴露的Li6.25PS4O1.25Cl0.75仍然保持着含少量Li2S杂质的硫银锗矿结构,与Li6PS5Cl的塌陷结构形成鲜明对比。此外,Xu等对Li9P3S12进行氧取代,采用熔体淬火方法制备了具有LGPS型结构的空气稳定的Li9P3S9O3。
除了硫的单氧取代来提高空气稳定性外,最近还采用了Li+、P5+和S2−两个位置的双取代来全面改善其性能,包括空气稳定性、离子导电性和与Li金属的界面稳定性。Liu等根据理论计算选择ZnO作为掺杂剂,分别用Zn2+和O2−部分取代P5+和S2-,合成了Li3+3xP1−xZnxS4−xOx(0≤x≤0.06)玻璃陶瓷电解质(图11g,h,i)。理论计算表明,x = 0.021时存在协同效应,O原子倾向于出现在Zn原子旁边,从而扩大了Li+的迁移通道(从而增加了离子电导率)。Chen等也采用了ZnO共掺杂策略,实现了Li6−2xZnxPS5−xOxBr(0≤x≤1.5)性能的全面增强。其中Li6PS5Br中的Li位被Zn原子取代,而不是P位,故仍然保持了较高的离子电导率。
最近,Ahmad等开发了一种Nb和O共掺杂策略来提高Li7P3S11微晶玻璃的化学/电化学稳定性。Li等人设计了Sn和O共取代策略,得到了Li7Sn0.5xP3−xS11−2.5xOx (x = 0.2),提高了对水分和Li金属的稳定性。Zhao等证明了Sb和O同族取代P和S对改善Li7P3S11的空气稳定性的有效性。由于形成了POS33-和P2OS64-的氧硫化物单元,Li7P3−xSbxS11−2.5xO2.5x (x = 0.1)的离子电导率和空气稳定性均增强了。最近,Tufail等人甚至用ZrO2和LiI掺杂对Li3P3S11进行了三次取代,得到了Li6.95Zr0.05P2.9S10.8O0.1I0.4 (LZPSOI) 电解质,其增强的空气稳定性归因于氧硫化物单元(即POS33-和P2OS64-)的形成。
因此,由于配位环境的改变(即氧原子部分取代硫原子并与硬酸P5+紧密结合),氧取代可以有效提高硫化电解质在空气中的稳定性。然而,为了获得满意的离子导电性和较高的空气稳定性,需要在较低的含量和较窄的范围内优化氧取代,形成一些有利的硫化氧单元,因为大量的氧取代会显著降低离子导电性。而引入另一种阳离子的共掺杂策略可以全面提高硫化电解质的性能,促进其实际应用。
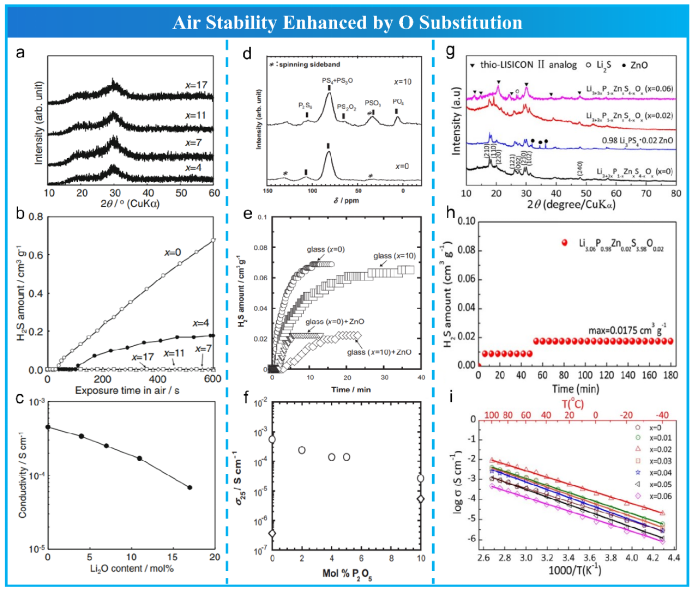
图11氧取代增强空气稳定性。
5.2.2软酸取代
Liang 基于HSAB理论提出,降低P含量可以提高Li10GeP2S12 (LGPS)的空气稳定性,因为硬酸P5+倾向于与硬碱O反应,形成P-O键,而不是保持原始的P- S键。受Na3SbS4在自然环境中以Na3SbS4·xH2O的形式稳定存在,他们预测Sb取代的LGPS(Li10Ge(P1−xSbx))将具有更好的空气稳定性和离子导电性,因为大的Sb5+离子可以拓宽Li+的扩散路径(图12 a,b,c,d)。随着Sb含量的增加,H2S的生成量不断减少。Ye等随后进行了Sb掺杂,得到了Li9.54Si1.74(P1-xSbx)1.44S11.7Cl0.3 (x = 0.097)。Tufail等在Li7P3S11中通过Sb和I双取代得到Li7Sb0.05P2.95S10.5I0.5 电解质(图12 e,f)。
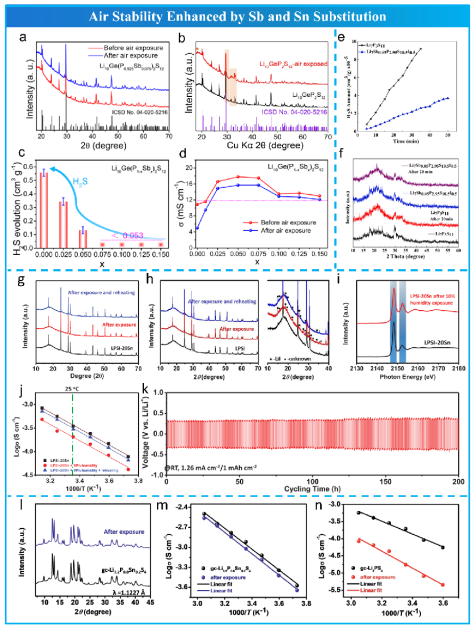
图12 Sb和Sn置换提高空气稳定性。
在HSAB理论指导下,Zhao等人利用另一种软酸Sn4+部分取代Li6PS5I (LPSI)中的硬酸P5+,合成了Sn掺杂的LPSI (LPSI- 20Sn),并通过各种表征方法证明了其优异的空气稳定性和良好的锂金属相容性(图12g,h,i,j,k)。采用密度泛函理论(DFT)计算了氧置换反应能(ΔE)。LPSI-20Sn的ΔE值越高,表明(P/Sn)S4四面体中(P/Sn)-S的键能比PS4四面体中P-S的键能更强。因此,Sn掺杂的LPSI-20Sn在环境空气中具有更稳定的晶体结构。Zhao等进一步合成了Sn取代的微晶玻璃Li3PS4 (gc-Li3.2P0.8Sn0.2S4),具有较高的离子导电性、改善的空气稳定性和良好的锂金属相容性(图12l,m,n)。此外,Rajagopal等人制备了Sn掺杂Li7P2S8I0.75Br0.25固体电解质。
Cu+ (74 pm)与Li+ (73 pm)离子半径相似,是一种软酸,很少被用来取代离子半径较小(31 pm)的强酸P5+。最近,Taklu等通过将P5+和S2-分别与Cu+和Cl-进行双取代,成功地获得了Li6+3xP1-xCuxS5-xClx (x = 0.1, LPSC-1)(图13a,b,c))。软酸Cu+的加入产生了强Cu-S键稳定了局域结构PS43-。稀土元素Ce3+被认为是软酸,Zhou等人首次验证了Ce3+通过与软酸S2-结合来增强空气稳定性,他们制备了Li7P2.9Ce0.2S10.9Cl0.3微晶玻璃 (图13e和f),证明Ce-S键对潮湿空气具有较高的稳定性。此外,Yu等人通过软酸As取代合成了Na3P0.62As0.38S4。
根据Mo等人的热力学分析结果,In3+是提高硫化电解质空气稳定性的良好候选掺杂剂。Jiang等通过掺入In3+增强了Li6PS5I (LPSI)的空气稳定性和离子导电性,如图13g,h,i所示。
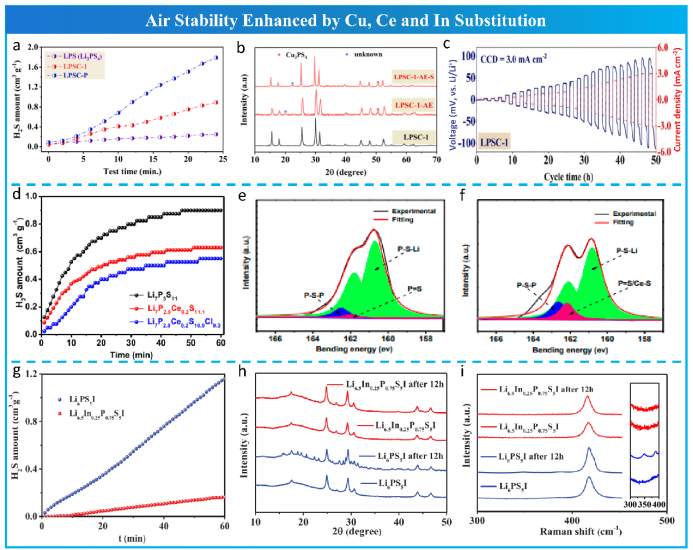
图13 Cu、Ce和In的替代增强了空气稳定性。
5.2.3其他元素替换
除氧和软酸取代提高硫化电解质的空气稳定性外,其他元素的取代也显示出一些积极的作用,尽管其机理复杂。Fukushima等人通过Li3N部分取代Li2S合成了(75-1.5x)Li2S·25P2S5·xLi3N微晶玻璃。其水稳定性增强是由于玻璃网络中交联的P和N的形成(图14a,b,c)。除了PS43-中键合的S2-外,未键合的S2-被认为是硫银锗矿结构中另一个易受氧气和水分进攻的部位。Subramanian等人用Brand报道的Li5.6PS4.6ClBr0.4电解质取代了非键合S2-,增强了空气稳定性和离子导电性(图14d,e,f)。Min等通过Al2S3部分取代P2S5合成了Li6+2xAlxP1−xS5Cl (x = 0, 0.025, 0.05, 0.075)。如图14g,h,i所示,Al3+含量从x= 0增加到x = 0.075时,H2S生成量受到抑制,验证了Al2S3替代提高了空气稳定性。
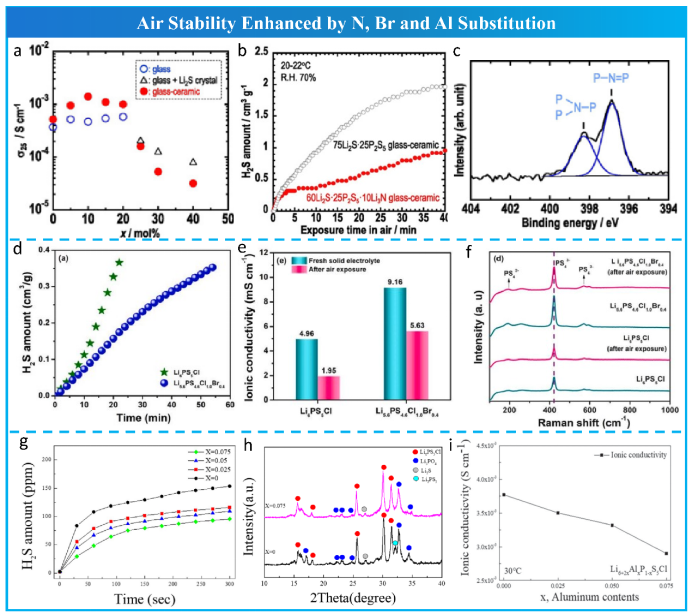
图 14 其他元素替代增强空气稳定性。
总之,元素取代是一种普遍的策略,可以以高自由度调整原子位点/含量,并保持改性硫化物电解质的均匀特性。然而,由于存在不稳定的 P-S 键,硬酸的部分取代可能导致不可逆的结构退化。此外,要获得令人满意的硫化物电解质的综合性能,还需要丰富的经验和实验尝试。
5.3 新材料设计
基于 HSAB 理论,通过用软酸 M/M'(例如,As、Sn和Sb)完全取代硬酸获得的 Li/Na-M-S三元或 Li/Na-M-M´-S四元硫化物电解质可能是实现最佳空气稳定性的方法。由于这些完全取代的电解质中的所有 S 原子都与软酸原子 M 共价键合,因此与部分取代的对应物相比,它们的空气稳定性将显着提高。
5.3.1 Li/Na-Sn-S体系
基于Li3x[LixSn1-xS2]的一系列快离子导体已经被确定,其中Li[Li0.33Sn0.67S2] (x=0.33,即Li2SnS3)和Li0.6[Li0.2Sn0.8S2] (x=0.2,即Li2Sn2S5)是具有相似层状结构的两个典型例子(图15A)。2014年,Kuhn等人首次通过简便的湿化学法合成了单斜晶系C2/c空间群(No. 15)的Li2SnS3。2015年,Brant等人采用固相法制备了热稳定性高达~750℃、空气稳定性优异的Li2SnS3(图15b)。Li2SnS3的快速离子传导是由于蜂窝状[SnS3]2-层之间的硫化锂层中Li(1)和Li(3)位点的高迁移率所致。2016年,Holzmann等人报道了单斜晶系C2/m空间群(No. 12)的贫锂相Li2Sn2S5。层间Li+位的部分占据(38%)有利于Li离子在共价Sn(Li)S2层间的扩散,故其拥有优异的离子电导率(1.5×10−2 S cm−1)。但是高的晶界阻抗和空气中的水化阻碍了Li2Sn2S5在全固态电池中的应用。幸运的是,Joos等人发现水化或水插层相Li2Sn2S5·xH2O(0<x≤10)的总离子电导率高达10−2 S cm−1。在潮湿的空气中,原始Li2Sn2S5经历了从无水相(x=0)到第一水化相(x≈2-4)和第二水化相(x≈8-10)的两步相变,导致了层间距的两步增加。此外有趣的是,离子电导率随着插层水含量的增加而增加,如图15c所示。在排除质子传导和Li+-H+内部交换的可能性后,他们推测Li+离子与层间水分子的耦合可能有效地加速了Li+的运动。
Kaib等人于2012年首次合成了离子电导率为7 × 10−5 S cm−1(20℃)的Li4SnS4 (LSS) 电解质。结果表明:(1)LSS可溶于极性溶剂(如甲醇或水);(2)溶剂缓慢蒸发后形成Li4SnS4·13MeOH或Li4SnS4·13H2O水合物;(3)LSS在320℃以上连续加热后可完全回收。如图15d和e所示,LSS在吸收13个水分子后,由正交(空间群Pnma, No.62)相转变为立方(空间群P213, No.198)相,而[SnS4]4−四面体结构仍保持不变。基于TGA和DSC(图15),他们进一步推测, 通过热处理300℃以上,13个水分子会被完全去除,0.5个水分子仍然在晶体结构中。随后,Choi等研究了LSS在形成水溶液后,在不同热处理温度下晶体结构的演变。在360℃~450℃范围内热处理回收的LSS的XRD谱图(图15g)与固相法合成的LSS的正交相的衍射峰吻合较好。而当加热温度为200℃~320℃时,出现了另一组“未知”的XRD谱图,并表现出非晶态特征。有趣的是,离子电导率(图15h)随热处理温度从200℃增加到450℃先增大后减小,在320℃时达到最大值1.4 × 10−4 S cm−1。虽然LSS的结晶度随加热温度从360℃增加到450℃而增加,但其离子电导率单调降低。如图15i所示,与LGPS相比,LSS的H2S生成量几乎可以忽略不计,说明SnS44−结构对水的稳定性较好。随后,Kanazawa等发现通过球磨和在260℃下热后处理的LSS的XRD(图15 j) 是类似于“未知”的XRD谱图(图15g)。最后,Riveld对加热到260℃的LSS的同步加速器XRD数据进行细化分析,发现“未知”的XRD谱图是空间群P63/mmc (No.194)中的六边形LSS。六方LSS的离子电导率高于正交LSS,这是因为其自由体积更大,更有利于离子导电。如图15k所示。Matsuda等利用LSS的水分稳定性,首次以Na4SnS4水溶液为原料,采用离子交换法制备了六边形LSS(图15l,m),实现了在环境条件下合成空气稳定的LSS 电解质。这种新型合成方法有利于低成本、大规模制备硫化电解质。
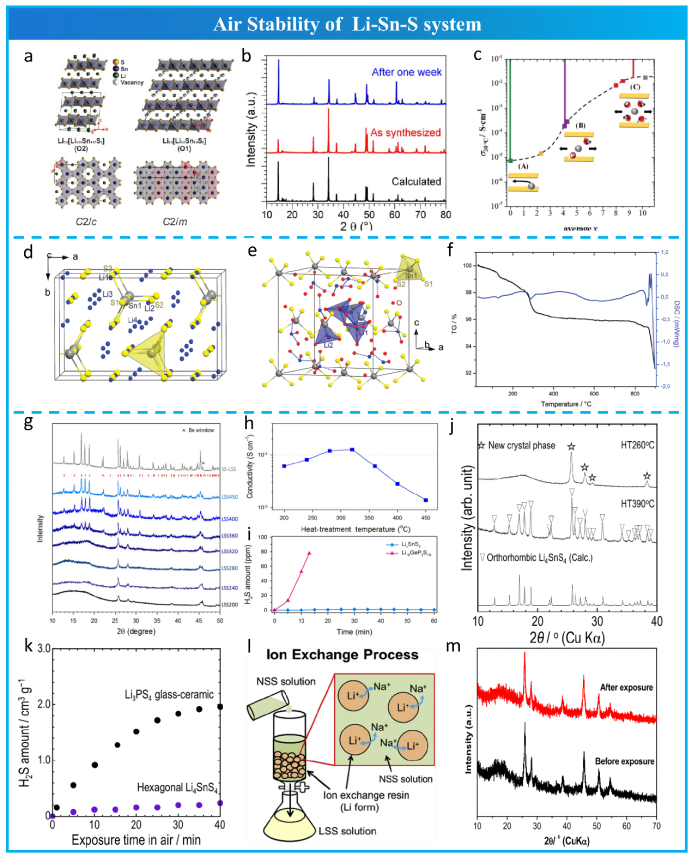
图15 Li-Sn-S系统空气稳定性。
为了提高LSS的离子电导率,人们做了大量的工作(正交LSS为3.1 × 10−4 S cm−1,六边形LSS为1.1 × 10−4 S cm−1)。Sahu 合成了Li3.833Sn0.833As0.166S4(图16 a,b,c),其离子电导率变高(1.39 × 10−3 S cm−1),这是由于将Sn替换为As创造了间隙或空位。遵循类似的As-取代 Li4SnS4, 最近卢普顺等制备了Li3.875Sn0.875As0.125S4 (LSAS),其具有最高的室温离子电导率值(2.45 mS cm−1), 并且是首次在环境气氛中由一步气相法合成。浸水后,LSAS的晶体结构(图16d)和局域结构(图16e)在350℃热处理后可以完全恢复。
考虑LSAS中 As的毒性, Zhang等人合成一个空气稳定和环境友好的Li4-xSn1-xSbxS4 (LSSS)。如图16 g,h,i所示。Kwak等也对Sn进行了Sb替代,通过进一步优化替代比例,得到了Li3.85Sn0.85Sb0.15S4(图16j,k), 其展现出优异的空气稳定性(图16m,n)。
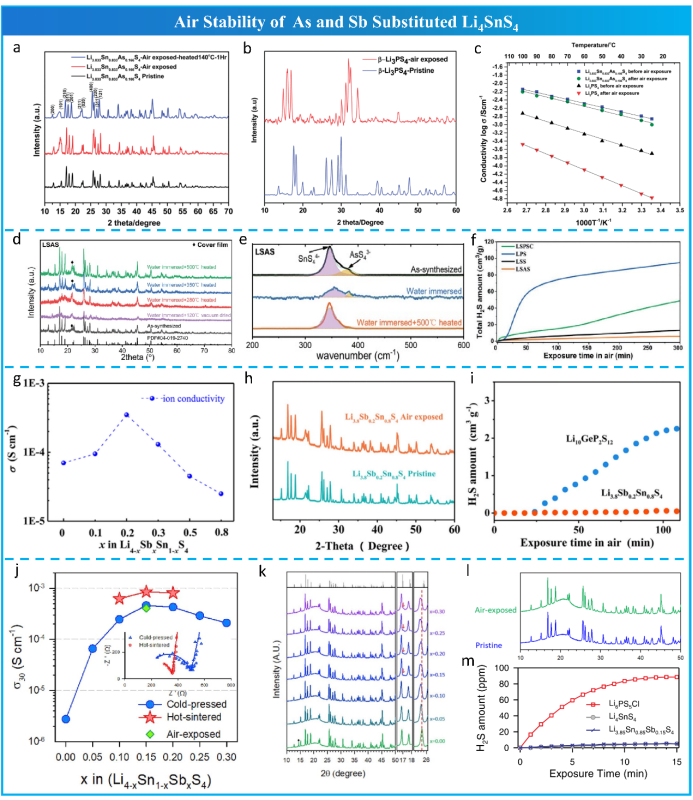
图16 As、Sb取代Li4SnS4的空气稳定性。
LSS 电解质具有良好的溶解性以及与湿涂工艺好的相容性。Park 将LiI和LSS 电解质溶解到无水甲醇溶剂中,通过调节这两种组分的比例,得到离子电导率为4.1×10−4 S cm−1的最佳0.4LiI-0.6Li4SnS4 电解质。xLiI-(1−x)Li4SnS4电解质(x < 0.5)呈非晶态,添加的LiI不以晶态存在,而是溶解在LSS中,起到玻璃化形成剂的作用,降低了LSS的结晶度。相比之下,在450℃下合成的无LiI的LSS结晶率较高。此外,值得注意的是,[SnS4]4−负离子基团始终保持稳定,不受加热温度和LiI引入的影响。因此,LiI的比例和结晶度(取决于加热温度)共同影响了xLiI-(1−x)Li4SnS4 电解质的离子电导率。
Na4SnS4和Na3SbS4分别作为Li4SnS4和Li3SbS4的类似物,也表现出优异的水分稳定性。虽然1973年Schiwy等人报道了一系列Na4SnS4水合物,但Na4SnS4作为固态离子导体在2018年由Heo等人首次报道。Heo等人发现了正方Na4−xSn1−xSbxS4(0.02≤x≤0.33)具有I41/acd空间群,与Na4SnS4或Na3SbS4明显不同。Na3.75Sn0.75Sb0.25S4除具有0.51 mS cm−1的高离子电导率外,还表现出良好的干空气稳定性和可恢复性。Jia等基于Na3.7[Sn0.67Si0.33]0.7P0.3S4的结构模板设计了Na4Sn0.67Si0.33S4.。虽然加入“硬酸”P5+提高了离子电导率,但Na3.7[Sn0.67Si0.33]0.7P0.3S4仍表现出良好的湿空气稳定性。Xiong等分别对Sn4+和S2-进行了Sb5+和Cl-双取代,得到了Na3.7Sn0.8Sb0.2S3.9Cl0.1。
5.3.2 Li/Na-Sb-S 体系
考虑到[SbS4]3−基团优异稳定性,Kimura等设计合成了空气稳定的锂离子导体Li3SbS4(图17a,c)。由于结构不同,Li3SbS4玻璃(1.5 × 10−6 S cm−1)的离子电导率远高于玻璃陶瓷Li3SbS4(图17b)。
2016 年,Wang等人通过加热完全去除Na3SbS4·9H2O水合物中的结晶水,创新合成了Na3SbS4固体电解质。由于Na3SbS4·9H2O在自然环境中是稳定的,根据HSAB理论,具有强Sb-S键的SbS43-基团应该是水稳定的(图17 d,e)。几乎同时,Zhang等还通过固相法合成了具有相同晶体结构( ,No.114)的 Na3SbS4。除了上述可逆的H2O 吸附/解吸和水分稳定性特性(图 17f)外,富含空位的 Na3SbS4 表现出更高的离子电导率。随后,Banerjee等报道了Na3SbS4的溶液加工性能,使全固态钠离子电池的Na3SbS4 涂层阴极成为可能。2018 年,Kim 等开发了一种可扩展的合成方法,从水溶液中制备 Na3SbS4。
,No.114)的 Na3SbS4。除了上述可逆的H2O 吸附/解吸和水分稳定性特性(图 17f)外,富含空位的 Na3SbS4 表现出更高的离子电导率。随后,Banerjee等报道了Na3SbS4的溶液加工性能,使全固态钠离子电池的Na3SbS4 涂层阴极成为可能。2018 年,Kim 等开发了一种可扩展的合成方法,从水溶液中制备 Na3SbS4。
2019年,Hayashi等人通过W6+部分取代Sb5+,将Na3SbS4的离子电导率从2.1 mS cm−1提高到32 mS cm−1。高价态W6+的引入有效地创造了Na空位,促进了从四方相到立方相的结构转变,实现了各向同性的三维快离子导电。制备的Na2.88Sb0.88W0.12S4除具有优异的离子导电性外,还表现出良好的水分稳定性(图17g)。同时,Fuchs等人报道了Na2.9Sb0.9W0.1S4类似物的离子电导率更高,为42±8 mS cm−1,这是迄今为止在硫化物电解质中测量到的最高值。随后,Yubuchi等人开发了Na3-xSb1-xWxS4的水溶液合成方法。受到空位引入的启发,Tsuji等人将S2-部分替换为Cl-,开发出了Na3xSbS4-xClx电解质(图17h,i)。
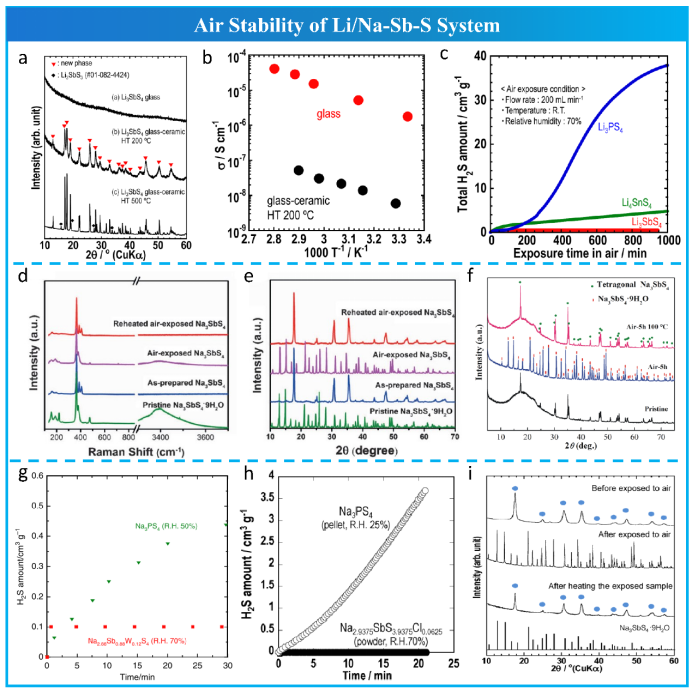
图17 Li/Na-Sb-S体系的空气稳定性。
5.3.3新型四元离子导体
受Wang等基于第一性原理计算对层状LiAlSO的预测的启发,Kuo等成功合成了具有层状结构的LiSnOS氧硫化物,有望结合氧化物电解质高化学稳定性和硫化物电解质高离子导电性的优点。LiSnOS粉体的制备采用了不同于传统固/液相法的新合成路线,包括SnOS的热沉淀法和煅烧/硫化步骤。离子电导率为1.92 × 10−4 S cm−1的LiSnOS可以在空气中稳定存在至少两周而不发生相分解。然而,尽管Gamon等人进行了多次实验尝试,到目前为止,LiAlSO和Li-Al-S-O体系中可能的类似物尚未被合成。
Li4PS4I是电解质Sedlmaier等人在2017年通过溶剂法合成的。它在P4/nmm (No. 129)四方空间群中具有一种新的晶体结构。Calpa等在2021年对其空气稳定性进行了系统研究XRD结果表明,暴露60min和1800min后形成的副产物LiI·H2O和LiI·3H2O是电解质中PS43-单元与空气中H2O分子之间的保护层。180℃干燥可恢复Li4PS4I的结构,,这是首次在硫代磷酸盐电解质中观察到可逆结构。
Wang等用Cu+完全取代LGPS中的P5+,通过尿热合成法得到空Li4Cu8Ge3S12(LCGS)。根据HSAB理论,Ge4+和Cu+作为软酸倾向于与软碱S2-紧密结合,如图 18a ,b,c所示。Li6SbS5I 及其衍生物 Li6+xMxSb1−xS5I (M = Si, Ge, Sn) 最早由 Zhou 等人开发。2019 年,尽管通过分别用 Ge4+和 Si4+ 代替 Sb5+ 可以将烧结的电解质片离子电导率提高到 18.4 和 24 mS cm-1,但没有进行空气稳定性研究。随后,Sun等发现 Ge 取代的 Li6SbS5I 的空气稳定性优于典型的硫化物电解质 Li6PS5Cl(图 18d)。Li等通过H2S含量、原位拉曼光谱和低温 TEM 系统研究了 Ge 取代 Li6SbS5I 的空气稳定性。由于 Ge4+和 Sb5+ 的中心阳离子是软酸,Li6SbS5I 和 Li6.5Ge0.5Sb0.5S5I 的空气稳定性明显优于磷基 LPSI(图 18e)。除了 Ge 取代的 Li6SbS5I 之外,Si 取代的 Li6SbS5I 也被证实比 LPSI 和未掺杂的 Li6SbS5I 更稳定(图 18f)。 然而,由于非键合 S2- 的化学稳定性较弱,Li6+xMxSb1-xS5I(M = Si、Ge、Sn)在暴露于湿气/水后的结构破坏应该是不可逆的。
尽管 LGPS 型 Na10MP2S12 (M = Si, Ge, Sn) 作为有前途的四元超离子导体被 Richards 等人预测,但除了离子电导率为 0.4 mS cm-1 的不纯 Na10SnP2S12 相之外,迄今为止几乎没有取得任何进展。2018年,Zhang等合成了 Na11Sn2PS12,其晶体结构与 LGPS 明显不同。随后,Ramos等制备了其类似物 Na11Sn2SbS12,其干燥空气稳定性比 Na11Sn2PS12 高得多(图 18i)。Weng等将 Na11Sn2SbS12的离子电导率提高了三倍(1.01 mS cm-1),并通过用 Ti 取代 Sb 避免了 NaSbS2 杂质。他们还证明了 Na11Sn2SbS12 具有出色的空气稳定性,如图 18j 所示。2021年,Liu等通过用 Sb5+ 完全替代Na11Sn2PS12中的 P5+,报道了离子电导率为 0.52 mS cm-1 的四元 Na10SnSb2S12 固体电解质。由于坚固的 Sn-S 和 Sb-S 键,Na10SnSb2S12表现出优异的空气稳定性 (图 18k)。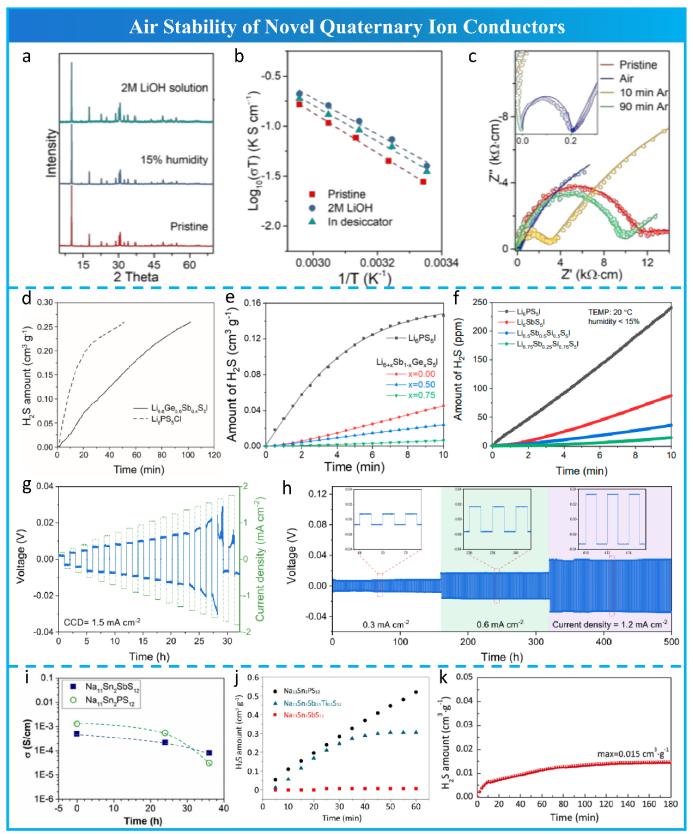
图 18 新型四元离子导体的空气稳定性。
5.4 表面工程
由于硫化物电解质与水分之间的水解反应首先发生在硫化物表面,因此建议构建惰性表面或涂层以抵抗 O2、水分子甚至有机溶剂的化学侵蚀,如图 19a 所示。Jung等合成了具有核壳结构的氧硫化物包覆的 Li6PS5Cl。从氧硫化物包覆的Li6PS5Cl的表面微观结构可以识别出 50 nm 厚的具有极高氧浓度的纳米层,该钝化层有效地抑制了表面的化学反应(图 19b,c)。最近,Xu等创新性地设计了一种超疏水表面层,在膜水平上具有防水和锂离子导电性能,如图 19d 所示。该保护层喷涂在Li6PS5Cl膜上,由Li1.4Al0.4Ti1.6(PO4)3 (LATP)纳米颗粒和氟化聚硅氧烷(F-POS)通过水解和缩合反应制备而成。如图19e所示,当水滴粘附在裸膜表面时,具有超疏水表面的膜表现出独特的防水效果。这种设计的膜具有出色的水稳定性。
因此,一个特殊设计的表面层不仅可以提高空气对水分和氧气的稳定性,而且还可以提高湿法过程中对有机成分的化学稳定性。此外,其他理想特性,如超疏水性和锂金属相容性,可以很容易地通过表面工程嫁接到硫化物电解质中。
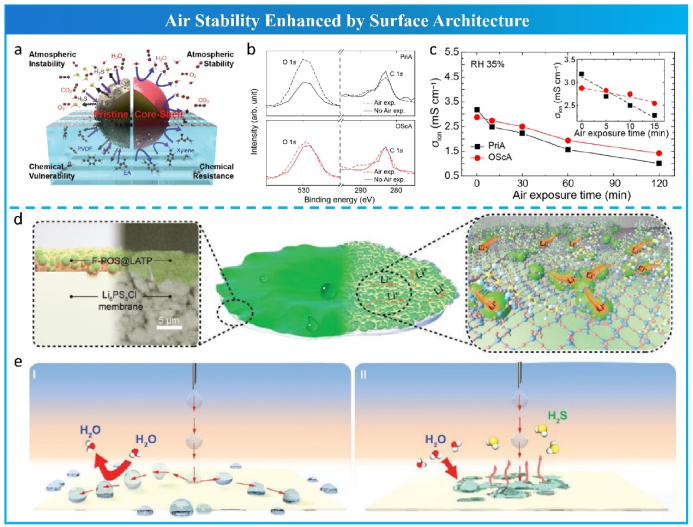
图 19 表面工程增强空气稳定性。
5.5 硫化物-聚合物复合固体电解质
除了硫化物电解质本身的改性方法外,还提出了硫化物与聚合物结合的方法。Li等人利用Li7PS6和 PVDF-HFP(图20a)制备了复合电解质,即使是在环境空气下,其结构保持良好(图20b,c)。Chen等人通过单浆料涂覆工艺和共价交联控制界面反应制备了由β-Li3PS4和聚甲基丙烯酸甘油酯(PGMA)组成的复合电解质,如图20d所示。其具备较好的空气稳定性 (图15e,f)。Tan等人将疏水聚合物聚苯乙烯-嵌段-聚(乙烯-正丁烯)-e-聚苯乙烯(SEBS)与Li7P3S11结合,得到了空气/湿度稳定的复合材料SEBS-Li7P3S11(图20g)。
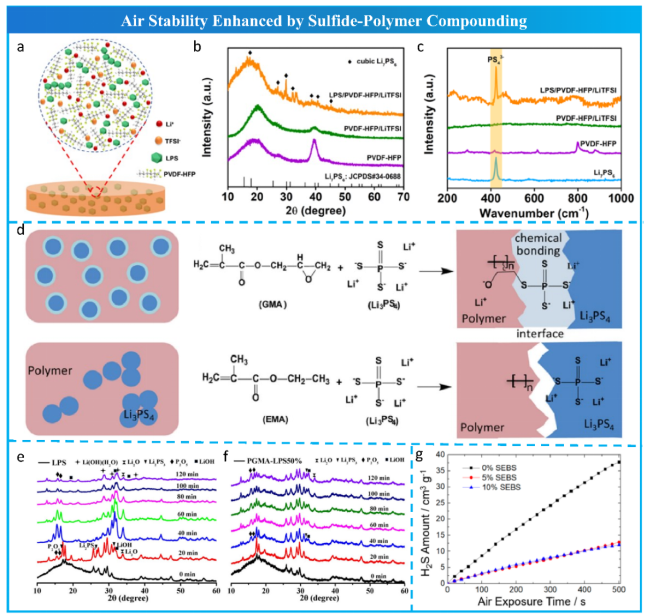
图20 .硫化物-聚合物复合增强空气稳定性。
综上所述,从理论机理、表征技术和改进策略等方面系统综述了硫化物电解质和全固态电池在空气稳定性方面的研究进展。从理论机理来看,玻璃无规则网络理论可以很好地指导玻璃电解质材料的改性,但其综合性能的提高仍然有限。HSAB理论已被普遍接受,并被证明是开发空气稳定硫化物电解质的有效方法。莫一非等基于水解反应的能量变化进行热力学分析,进一步丰富了空气稳定硫化物电解质的替代阳离子选择。界面反应动力学加深了对硫化物电解质表面空气不稳定问题的认识。此外,空气稳定性表征技术也逐渐优化,研究暴露于空气前后的宏观化学反应现象、微观化学成分/结构、电化学性能/性能。基于实验,五种策略已被证明能够有效的提高硫化物电解质的空气稳定性。这五种策略的特点、优缺点在表3中进行了总结。
表3 | 各种空气稳定性改善策略的比较
策略 | 特点 | 优点 | 缺点 |
硫化氢吸收剂 | 与硫化电解质物理混合 | 吸收有毒H2S气体,提高安全性 | 阻碍粒子间离子传导;不可避免的水解反应和结构降解 |
元素替换 | 对化学成分的修饰 | 均一性质;可调整原子的位置和种类,具有高自由度;抑制水解反应 | 需要丰富的经验;需要大量的实验尝试;不可逆的结构退化 |
新材料设计 | 新的组成或结构 | 丰富了硫化物电解质的种类;避免了水解反应和结构降解 | 需要可靠的指导方针;需要大量的实验尝试 |
表面工程 | 设计具有特殊结构或功能的表面层 | 不影响电解质本体;用途广泛;抑制水解反应 | 阻碍离子在表面/界面传导;体相和表面具有异质性 |
硫化物-聚合物复合 | 两者物理或化学复合 | 柔韧性好;加工简单且可扩展;抑制水解反应 | 需要大量的实验尝试;硫化物与聚合物具有异质性 |
尽管近年来取得了重大进展,但硫化物基全固态电池的实际应用和商业化仍面临许多挑战。基于对上述空气稳定性问题的深入理解,本文提出了几个潜在的方向:
1)发展S/P位点部分取代、S/P位点双取代,甚至多位取代触发协同效应并满足硫化物电解质的综合先决条件;
2)基于理论预测和具有新结构的空气稳定硫化物电解质(例如Li4Cu8Ge3S12和LiSnOS)开发Li-M-S(M是软酸)三元体系新材料;
3)开发硫化物-聚合物复合电解质,以结合这两种电解质的互补优势,例如聚合物电解质的柔韧性和可扩展加工性以及硫化物电解质的高Li+转移数和优异的室温离子电导率;
4) 开发表面改性方法(例如,表面氧化和表面纳米结构设计)以保持硫化物电解质优异的体相离子电导率,并潜在地利用表面层的各种功能,例如钝化硫化物电解质与空气之间的界面反应,抑制硫化物电解质与氧化物正极之间的空间电荷层效应,提高硫化物电解质与氧化物正极或锂金属负极的相容性,消除颗粒间的晶界等;
5)除了调整化学成分外,进一步开发精细调控材料物理性质的方法,如粒度、比表面积、结晶度和暴露的晶面。另外还要开发新的合成路线/方法,如离子交换法 、“脲热”合成法和气相合成法等,将有可能促进硫化物电解质的量产。
此外,应标准化H2S生成量的准确测量,以实现不同研究组报告的各种硫化物电解质的可比数据。推荐使用我们之前的工作 中报道的自制检测系统或先进的气相色谱-质谱法。除标准化检测体系外,湿度、温度、样品形式、样品质量等检测条件也应标准化。考虑到当前制造过程的各种湿度条件,包括材料制备、储存、运输、浆料涂布、电池组装/包装以及各种硫化物电解质的不同空气稳定性能,建议在以下条件下测量所有硫化物电解质的H2S气体量,例如浆液涂布工艺的干燥室湿度(2%RH)对应的露点为-28℃。对于具有出色空气稳定性或可逆吸水/解吸能力的硫化物电解质,可以在高湿度 (> 50%RH) 或直接暴露于水中等恶劣条件下研究其耐受性。测试温度和样品形式分别以25℃和粉末状态为宜。鉴于H2S传感器的可检测范围和准确度,样品质量应在合理范围内,并在根据公式(2)计算H2S总量时进行归一化。
此外,硫化物电解质的空气稳定性表征方法仍亟待改进和丰富。先进的原位环境表征方法将有力地从收集的动力学演化信息中揭示硫化物电解质与空气之间的界面反应机制。除了用于分析硫化物电解质反应产物随暴露时间演变的原位 XRD 之外,Tsukasaki 等开发了一种 TEM 系统来评估电池材料的空气稳定性,并在气流环境下原位观察硫化物基 Li4SnS4 玻璃陶瓷的劣化过程。此外,建议采用基本和通用的表征方法,包括暴露时H2S生成量的测量、晶体结构的 XRD 和局部结构的拉曼光谱以及暴露前后离子电导率的测量,以为不同实验室的可比数据构建统一的评价体系。先进的表征方法,如 XAS、NMR 和原位 TEM,可以作为提供进一步证明和加深理解的替代方法。
总体而言,非常希望继续努力克服上述挑战,以便从实验室研究转移到未来空气稳定的硫化物电解质和全固态电池的大规模应用中。

课题组近期论文

https://www.x-mol.com/groups/wu_fan/publications
1. Solid state ionics - selected topics and new directions
F. Wu, L. Liu, S. Wang, J. Xu, P. Lu, W. Yan, J. Peng, D. Wu, H. Li*
Progress in Materials Science (IF=48.165), 2022, 126,100921.
https://doi.org/10.1016/j.pmatsci.2022.100921
2. Progress in Solvent-Free Dry-Film Technology for Batteries and Supercapacitors
Y. Li, Y. Wu, Z. Wang, J. Xu, T. Ma, L. Chen, H. Li*, F. Wu*
Materials Today (IF=31.041), 2022, 55,92-109.
https://doi.org/10.1016/j.mattod.2022.04.008
3. Long-Life Lithium-Metal All-Solid-State Batteries and Stable Li Plating Enabled by In-situ Formation of Li3PS4 in SEI Layer
J. Xu, J. Li, Y. Li, M. Yang, L. Chen, H. Li, F. Wu*
Advanced Materials(IF=32.086), 2022, in press.
https://DOI:10.1002/adma.202203281
4. Long-life Sulfide All-solid-state Battery Enabled by Substrate-Modulated Dry-Process Binder.
Y. Li, Y. Wu, T. Ma, Z. Wang, Q. Gao, J. Xu, L. Chen, H. Li, F. Wu*
Advanced Energy Materials(IF=29.698), 2022, 01732.
https://DOI: 10.1002/aenm.202201732
5. Air Stability of Sulfide Solid-state Batteries and Electrolytes
P. Lu#, D. Wu#, L. Chen, H. Li*, F. Wu*
Electrochemical Energy Reviews (IF=32.804), 2022, accepted.
6. Improving Thermal Stability of Sulfide Solid Electrolytes: An Intrinsic Theoretical Paradigm
S. Wang, Y. Wu, H. Li, L. Chen, F. Wu*
Infomat(IF=25.405)2022, 212316.
https://onlinelibrary.wiley.com/doi/10.1002/inf2.12316
7. Interfacial and Cycle Stability of Sulfide All-Solid-State Batteries with Ni-Rich Layered Oxide Cathodes
J. Wang, Z. Zhang, J. Han, X. Wang, L. Chen, H. Li, F. Wu*
Nano Energy (IF=19.069), 2022, 107528.
https://www.sciencedirect.com/science/article/abs/pii/S221128552200605X
8. Doping Strategy and Mechanism for Oxide and Sulfide Solid Electrolytes with High Ionic Conductivity
Y. Wang, Y. Wu, Z. Wang, L. Chen, H. Li*, F. Wu*
Journal of Materials Chemistry A (IF=14.511), 2022, 10, 4517 - 4532
https://doi.org/10.1039/D1TA10966A
9. Air/water Stability Problems and Solutions for Lithium Batteries
M. Yang, L. Chen, H. Li*, F. Wu*
Energy Materials Advances, 2022, accepted.
10. Stable Ni-rich layered oxide cathode for sulfide all-solid-state lithium battery
Y. Wang, Z. Wang, D. Wu, Q. Niu, P. Lu, T. Ma, Y. Su, L. Chen, H. Li, F. Wu*
eScience,2022, accepted.
https://www.sciencedirect.com/science/article/pii/S2667141722000738
11. Progress in Lithium Thioborate Superionic Conductors
X. Zhu, Z. Zhang, L. Chen, H. Li. Fan Wu*
Journal of Materials Research (invited paper), 2022, accepted.
https://doi.org/10.1557/s43578-022-00592-4
12. Liquid-phase Synthesis of Li2S and Li3PS4 with Lithium-based Organic Solutions
J. Xu, Q. Wang, W. Yan, L. Chen, H. Li. F. Wu*
Chinese Physics B, 2022, accepted.
https://iopscience.iop.org/article/10.1088/1674-1056/ac7459/pdf
13. Superior all-solid-state batteries enabled by gas-phase synthesized sulfide electrolyte with ultra-high moisture stability and ionic conductivity.
P. Lu, L. Liu, S. Wang, J. Xu, J. Peng, W. Yan, Q. Wang, H. Li, L. Chen, F. Wu*.
Advanced Materials(IF=32.086), 2021, 2100921.
https://doi.org/10.1002/adma.202100921
14. Water-Stable Sulfide Solid Electrolyte Membranes Directly Applicable in All-Solid-State Batteries Enabled by Superhydrophobic Li+-conducting Protection Layer
J. Xu, Y. Li, P. Lu, W. Yan, H. Li, L. Chen, F. Wu*.
Advanced Energy Materials(IF=29.698), 2021, 2102348.
https://onlinelibrary.wiley.com/doi/10.1002/aenm.202102348
15. High Current Density and Long Cycle Life Enabled by Sulfide Solid Electrolyte and Dendrite-Free Liquid Lithium Anode
J. Peng, D. Wu, F. Song, S. Wang, Q. Niu, J. Xu, P. Lu, H. Li, L. Chen, F. Wu*.
Advanced Functional Materials(IF=19.924), 2021, 2105776.
https://onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202105776
16. 5V-Class Sulfurized Spinel Cathode Stable in Sulfide All-Solid-State Batteries
Y. Wang, Y. Lv, Y. Su, L. Chen, H. Li, F. Wu*.
Nano Energy (IF=19.069), 2021, 90,106589.
https://doi.org/10.1016/j.nanoen.2021.106589
17. Progress in Thermal Stability of All-Solid-State-Li-Ion-Batteries
Y. Wu#, S. Wang#, H. Li, L. Chen, F. Wu*.
Infomat(IF=25.405), 2021, 1-27 (Cover Image)
https://doi.org/10.1002/inf2.12224
18. Application of Si-based Anodes In Sulfide Solid-State Batteries.
W. Yan, F. Wu*, H. Li, L. Chen.
Energy Storage Science and Technology, 2021, 10(3): 821-835.
共同第一作者:
卢普顺:男,2018年本科毕业于厦门大学,目前中科院物理所博士在读,研究方向为硫化物固体电解质和硫化物基全固态电池。
伍登旭:男,2021年本科毕业于北京理工大学化学与化工学院,现为中科院物理所硕士一年级研究生。主要研究方向为硫化物固态电解质及其界面问题。
合作作者:
陈立泉:中科院物理所博士生导师。中国工程院院士。北京星恒电源股份有限公司技术总监。曾任亚洲固体离子学会副主席,中国材料研究学会副理事长,2004年至今任中国硅酸盐学会副理事长。主要从事锂电池及相关材料研究,在中国首先研制成功锂离子电池,解决了锂离子电池规模化生产的科学、技术与工程问题,实现了锂离子电池的产业化。近年来,开展了全固态锂电池、锂硫电池、锂空气电池、室温钠离子电池等研究,为开发下一代动力电池和储能电池奠定了基础。曾获国家自然科学奖一等奖、中科院科技进步奖特等奖和二等奖,2007年获国际电池材料协会终身成就奖。2001年当选为中国工程院院士。
通讯作者:
李泓:中科院物理所博士生导师。北京凝聚态物理国家实验室副主任。科技部先进能源领域储能子领域主题专家,工信部智能电网技术与装备重点专项项目责任专家,国家新能源汽车创新中心技术专家。国家杰出青年科学基金获得者。国家重点研发计划新能源汽车试点专项动力电池项目,北京市科委固态电池重点项目,国家自然科学基金委固态电池重点项目负责人。联合创办北京卫蓝新能源科技有限公司、溧阳天目先导电池材料科技有限公司、中科海钠科技有限公司、天目湖先进储能技术研究院有限公司,长三角物理研究中心有限公司。主要研究领域包括:高能量密度锂离子电池、固态锂电池、电池失效分析、固体离子学。合作发表SCI论文380篇,引用超过27000次,H因子84。共申请中国发明专利100余项,已获授权中国发明专利50余项。
吴凡:中科院物理所博士生导师。发表SCI论文68篇,申请中国、美国、国际发明专利40项。兼任长三角物理研究中心科学家工作室主任、天目湖先进储能技术研究院首席科学家、中国科学院大学教授。入选国家海外高层次人才引进计划、中科院海外杰出人才引进计划及择优支持、江苏省杰出青年基金。获全国未来储能技术挑战赛一等奖; 中国科学院物理研究所科技新人奖;江苏青年五四奖章;江苏青年双创英才;江苏青年U35攀峰奖;常州市五一劳动奖章; 常州市突出贡献人才;常州市十大杰出青年;常州市十大科技新锐;华为优秀创新人才奖及创新探索团队奖;年度新能源领域最受关注研究工作等。任中国能源学会副主任;中国共产党江苏省党代会党代表;江苏省青年科学家年会执委会副秘书长;江苏省青科协理事;常州市青联常委等。